Les amines ont des hydrogènes acides sur le groupe amino. Ces hydrogènes peuvent être soustraits à l'aide de bases fortes (organométalliques, hydrures métalliques) formant des amides (bases amines).
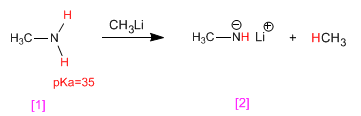
La méthylamine [1] réagit avec le méthyllithium en se transformant en sa base conjuguée, le méthylamidure de lithium [2] . De son côté, le méthyllithium se transforme en son acide conjugué, le méthane.
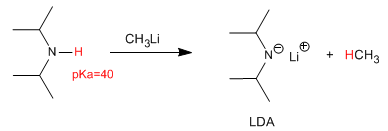
La déprotonation de la diisopropylamine produit l'une des bases les plus utilisées en chimie organique, le lithium diisopropylamide (LDA).
Cependant, le comportement le plus important des amines est basique. Les amines sont les substances organiques neutres les plus élémentaires.
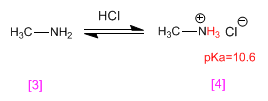
La méthylamine [3] est protonée pour devenir du chlorure de méthylammonium (sel d'ammonium) [4] . Les sels d'ammonium sont les acides conjugués des amines et ont des pKa allant de 9 à 11.
La basicité des amines dépend des effets inductifs et stériques. Ainsi, le pKa augmente avec la longueur de la chaîne carbonée (effet inductif).
CH3NH2 pKa = 10,6
CH 3 CH 2 NH 2 pKa = 10,8
(CH 3 ) 3 CNH 2 pKa = 10,4
La chaîne carbonée charge le groupe amino, par effet inductif, en augmentant sa basicité. La base forte a un acide conjugué faible, donc le pKa augmente. Mais si la chaîne est très volumineuse, les effets stériques commencent à prédominer, entraînant une diminution du pKa.