Amine haben saure Wasserstoffatome an der Aminogruppe. Diese Wasserstoffe können unter Verwendung starker Basen (organometallische Metallhydride) unter Bildung von Amiden (Aminbasen) subtrahiert werden.
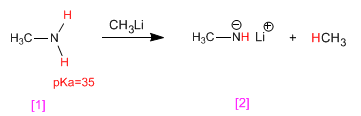
Methylamin [1] reagiert mit Methyllithium und wandelt sich in seine konjugierte Base, Lithiummethylamid [2] um. Methyllithium wird seinerseits in seine konjugierte Säure Methan umgewandelt.
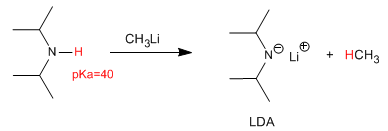
Die Deprotonierung von Diisopropylamin erzeugt eine der am häufigsten verwendeten Basen in der organischen Chemie, Lithiumdiisopropylamid (LDA).
Das wichtigste Verhalten von Aminen ist jedoch basisch. Amine sind die grundlegendsten neutralen organischen Substanzen.
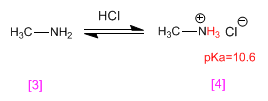
Methylamin [3] wird zu Methylammoniumchlorid (Ammoniumsalz) [4] protoniert. Ammoniumsalze sind die konjugierten Säuren von Aminen und haben pKas im Bereich von 9 bis 11.
Die Basizität von Aminen hängt von den induktiven und sterischen Effekten ab. Somit steigt der pKa mit der Länge der Kohlenstoffkette (induktiver Effekt).
CH3NH2 pKa = 10,6
CH 3 CH 2 NH 2 pKa = 10,8
(CH 3 ) 3 CNH 2 pKa = 10,4
Die Kohlenstoffkette lädt die Aminogruppe durch induktiven Effekt auf, wodurch ihre Basizität erhöht wird. Die starke Base hat eine schwache konjugierte Säure, sodass der pKa steigt. Wenn die Kette jedoch sehr voluminös ist, beginnen sterische Effekte zu überwiegen, was zu einer Abnahme des pKa führt.