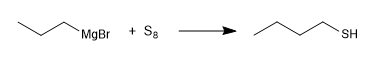Les thiols sont caractérisés par le fait qu'ils contiennent le groupe fonctionnel -SH. Ils sont nommés en terminant le nom de la chaîne principale en -thiol, analogue aux alcools dont la terminaison est -ol
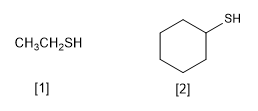
[1] Éthanothiol
[2] Cyclohexanethiol
Les thiols ont une acidité plus élevée que les alcools en raison de la plus grande taille du soufre par rapport à l'oxygène. Les valeurs de pKa se situent autour de 10-11, par rapport aux alcools qui ont des valeurs comprises entre 16 et 18.
Cependant, la plus grande taille du soufre favorise sa polarisabilité et par conséquent sa nucléophilie. Les thiols sont de bien meilleurs nucléophiles que les alcools, leur nucléophilie étant encore renforcée par la déprotonation.
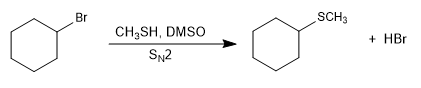
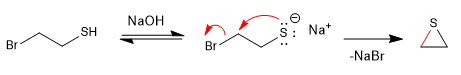
Les réactions de type S N 2 deviennent plus rapides en présence d'un milieu basique qui génère le sel de l-thiol (thiolate).
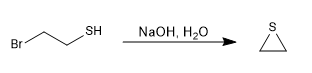
Mécanisme:
Les thiols sont préparés à partir d'hydrogène sulfuré de sodium et d'un haloalcane primaire ou secondaire.
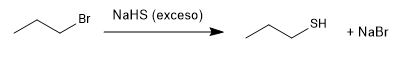
Le sulfure d'hydrogène en excès tente de minimiser la réaction secondaire par laquelle le propanethiol réattaque le bromure de propyle pour donner un thioéther.
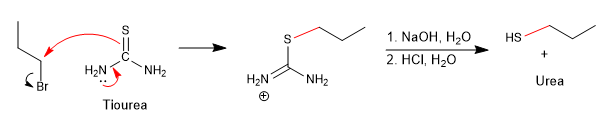
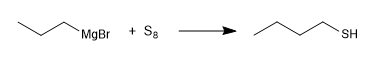
Une façon d'éviter cette réaction secondaire consiste à utiliser la thiourée en combinaison avec un haloalcane.

Une autre méthode de synthèse consiste en la réaction du magnésium avec le soufre élémentaire.