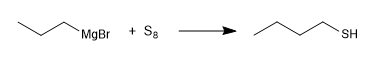Thiole sind dadurch gekennzeichnet, dass sie die funktionelle -SH-Gruppe enthalten. Sie werden benannt, indem der Hauptkettenname auf -thiol endet, analog zu Alkoholen, deren Endung -ol ist
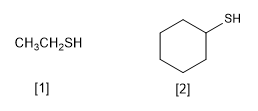
[1] Ethanothiol
[2] Cyclohexanthiol
Thiole haben aufgrund der größeren Schwefelgröße im Vergleich zu Sauerstoff einen höheren Säuregehalt als Alkohole. Die pKa-Werte liegen bei etwa 10-11, verglichen mit Alkoholen, die Werte zwischen 16-18 haben.
Die größere Größe des Schwefels begünstigt jedoch seine Polarisierbarkeit und folglich seine Nucleophilie. Thiole sind viel bessere Nucleophile als Alkohole, wobei ihre Nucleophilie durch Deprotonierung weiter verstärkt wird.
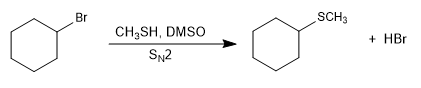
Reaktionen vom S N 2-Typ werden in Gegenwart eines basischen Mediums, das das l-Thiol-(Thiolat)-Salz erzeugt, schneller.
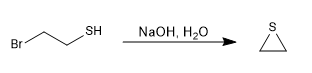
Mechanismus:
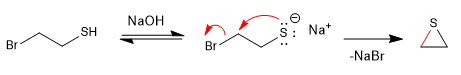
Die Thiole werden aus Natriumhydrogensulfid und einem primären oder sekundären Halogenalkan hergestellt.
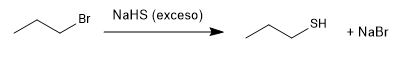
Der überschüssige Schwefelwasserstoff versucht, die Nebenreaktion zu minimieren, wodurch das Propanthiol das Propylbromid erneut angreift, um einen Thioether zu ergeben.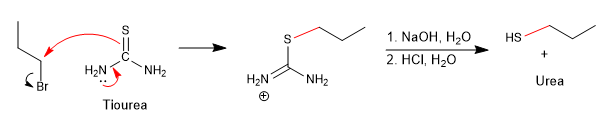
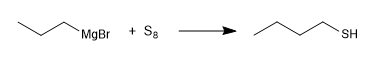
Eine Möglichkeit, diese Nebenreaktion zu vermeiden, besteht darin, Thioharnstoff in Kombination mit einem Halogenalkan zu verwenden.

Eine andere Synthesemethode besteht in der Reaktion von Magnesium mit elementarem Schwefel.