Alkana adalah senyawa hibridisasi sp 3 pada semua karbon. Empat substituen yang dimulai dari setiap karbon disusun menuju simpul tetrahedron.
Jarak dan sudut ikatan ditunjukkan pada model berikut. 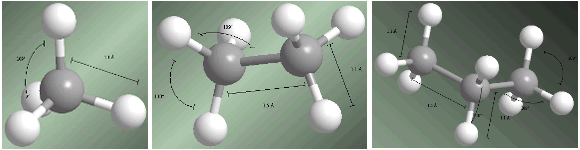
Alkana yang lebih kecil, metana, etana, propana, dan butana, adalah gas pada suhu kamar. Alkana linier dari C 5 H 12 hingga C 17 H 36 adalah cairan. alkana dari  jumlah karbon yang lebih tinggi padat pada suhu kamar.
jumlah karbon yang lebih tinggi padat pada suhu kamar.
Titik leleh dan titik didih alkana meningkat dengan jumlah karbon dalam molekul. Juga diamati bahwa alkana bercabang memiliki titik didih lebih rendah daripada isomer liniernya.
Grafik berikut menunjukkan titik didih alkana linier (berwarna hitam) dan yang sesuai dengan isomer 2-metilalkana (berwarna biru). 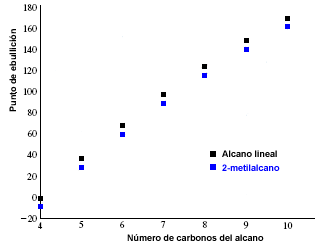
Dalam fase cair ada gaya tarik-menarik antar molekul yang menyatukannya. Untuk melewatkan zat ke fase gas, gaya antarmolekul ini perlu diatasi melalui input energi. 
Dalam molekul netral, seperti alkana, gaya tarik-menarik disebabkan oleh interaksi van der Waals yang dapat terdiri dari tiga jenis: interaksi dipol-dipol, dipol yang diinduksi dipol dan interaksi dipol yang diinduksi dipol yang diinduksi.
Pembentukan dipol terinduksi yang menghasilkan tarikan antar molekul netral dapat dilihat pada skema berikut: 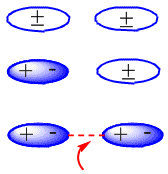
Mari kita pertimbangkan isomer pentana, sebagai contoh penurunan titik didih, ketika beralih dari alkana linier ke bercabang.
Pentana memiliki luas permukaan yang besar yang memungkinkan sejumlah besar interaksi dipol terinduksi – dipol terinduksi. 2-Methylbutane lebih kompak dan memiliki luas permukaan yang lebih rendah, interaksi antarmolekul yang lebih sedikit, dan titik didih yang lebih rendah.