Alkane sind sp 3 -hybridisierte Verbindungen an allen Kohlenstoffen. Die vier Substituenten, die von jedem Kohlenstoff ausgehen, sind zu den Eckpunkten eines Tetraeders hin angeordnet.
Bindungsabstände und -winkel werden bei den folgenden Modellen angezeigt. 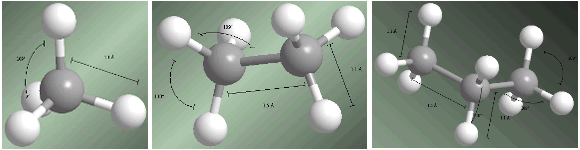
Die kleineren Alkane Methan, Ethan, Propan und Butan sind bei Raumtemperatur Gase. Lineare Alkane von C 5 H 12 bis C 17 H 36 sind Flüssigkeiten. Alkane von  eine höhere Anzahl von Kohlenstoffen ist bei Raumtemperatur fest.
eine höhere Anzahl von Kohlenstoffen ist bei Raumtemperatur fest.
Die Schmelz- und Siedepunkte von Alkanen steigen mit der Anzahl der Kohlenstoffe im Molekül. Es wird auch beobachtet, dass verzweigte Alkane einen niedrigeren Siedepunkt haben als ihre linearen Isomere.
Die folgende Grafik zeigt die Siedepunkte von linearen Alkanen (in Schwarz) und denen, die ihren 2-Methylalkan-Isomeren entsprechen (in Blau). 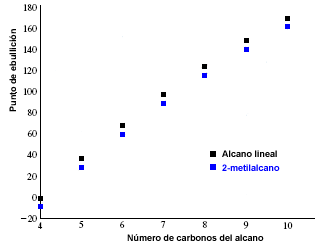
In der flüssigen Phase wirken Anziehungskräfte zwischen Molekülen, die sie zusammenhalten. Um die Substanz in die Gasphase zu überführen, müssen diese zwischenmolekularen Kräfte durch Energiezufuhr überwunden werden. 
In neutralen Molekülen wie Alkanen beruhen die Anziehungskräfte auf Van-der-Waals-Wechselwirkungen, die drei Arten aufweisen können: Dipol-Dipol-, Dipol-induzierte Dipol- und induzierte Dipol-induzierte Dipol-Wechselwirkungen.
Die Bildung von induzierten Dipolen, die die Anziehung zwischen neutralen Molekülen erzeugen, ist im folgenden Schema zu sehen: 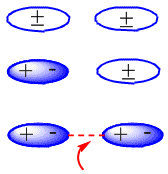
Betrachten wir als Beispiel für die Siedepunktserniedrigung beim Übergang von linearen zu verzweigten Alkanen die Pentanisomere.
Pentan hat eine große Oberfläche, die eine große Anzahl von induzierten Dipol-induzierten Dipol-Wechselwirkungen ermöglicht. 2-Methylbutan ist kompakter und hat eine geringere Oberfläche, weniger intermolekulare Wechselwirkungen und einen niedrigeren Siedepunkt.