Les alcanes sont des composés hybrides sp3 sur tous les carbones. Les quatre substituants qui partent de chaque carbone sont disposés vers les sommets d'un tétraèdre.
Les distances et les angles de liaison sont indiqués sur les modèles suivants. 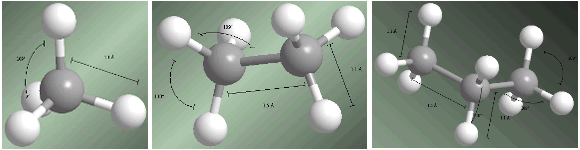
Les alcanes plus petits, le méthane, l'éthane, le propane et le butane, sont des gaz à température ambiante. Les alcanes linéaires de C5H12 à C17H36 sont des liquides. alcanes de  un plus grand nombre de carbones sont solides à température ambiante.
un plus grand nombre de carbones sont solides à température ambiante.
Les points de fusion et d'ébullition des alcanes augmentent avec le nombre de carbones dans la molécule. On observe également que les alcanes ramifiés ont un point d'ébullition inférieur à leurs isomères linéaires.
Le graphique suivant montre les points d'ébullition des alcanes linéaires (en noir) et ceux correspondant à leurs isomères 2-méthylalcanes (en bleu). 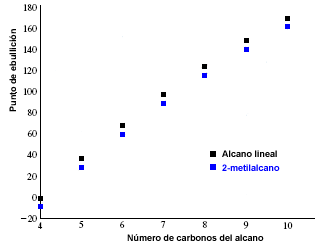
Dans la phase liquide, il existe des forces d'attraction entre les molécules qui les maintiennent ensemble. Pour faire passer la substance en phase gazeuse, il est nécessaire de vaincre ces forces intermoléculaires par l'apport d'énergie. 
Dans les molécules neutres, comme les alcanes, les forces attractives sont dues aux interactions de van der Waals qui peuvent être de trois types : interactions dipôle-dipôle, dipôle induit dipôle et induit dipôle induit dipôle.
La formation de dipôles induits qui produisent l'attraction entre les molécules neutres peut être observée dans le schéma suivant : 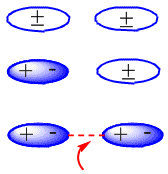
Considérons les isomères du pentane, comme exemple de la diminution du point d'ébullition, lors du passage d'alcanes linéaires à ramifiés.
Le pentane a une grande surface qui permet un grand nombre d'interactions dipôle induit – dipôle induit. Le 2-méthylbutane est plus compact et a une surface plus faible, moins d'interactions intermoléculaires et un point d'ébullition plus bas.