Nucleófilos são bases de Lewis que atacam um carbono, deslocando o grupo abandonador. Nucleófilos iônicos são comuns, mas também existem numerosos exemplos de nucleófilos neutros. A característica geral de todos os nucleófilos é a presença de pares solitários no átomo atacante.
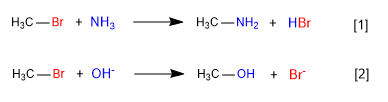
[1] Lento
[2] Rápido
Na primeira reação, a amônia atua como uma espécie nucleófila neutra, mas com pares solitários no nitrogênio, deslocando o bromo do carbono e formando uma amina.
Na segunda reação, o íon hidróxido atua como um nucleófilo, deslocando o bromo e formando um álcool. Observa-se que a primeira reação é mais lenta que a segunda, concluindo que a amônia é um nucleófilo pior que o íon hidróxido.
A capacidade de um nucleófilo atacar um substrato é conhecida como nucleofilicidade.A nucleofilicidade depende de vários fatores: posição do átomo atacante na tabela periódica, carga e ressonância.
Carga - Espécies carregadas são melhores nucleófilos do que as neutras
OH ->> H 2 O íon hidróxido (espécie carregada) melhor nucleófilo do que a água (espécie neutra)
NH 2 ->> NH 3 íon amida (espécie carregada) melhor nucleófilo do que amônia (espécie neutra)
PH 2 ->> PH 3 íon fosfeto (espécie carregada) melhor nucleófilo do que fosfina (espécie neutra)
Posição na tabela periódica - A nucleofilicidade aumenta descendo na tabela periódica e movendo-se para a esquerda.
NH 3> H 2 O amônia é um nucleófilo melhor do que a água porque o nitrogênio está mais à esquerda do que o oxigênio
I -> Cl - iodeto é um nucleófilo melhor que o cloreto porque é mais baixo.
PH 3> NH 3 A fosfina é um nucleófilo melhor que a amônia porque o fósforo é mais baixo que o nitrogênio.
Ressonância - A ressonância diminui a nucleofilicidade. A deslocalização de pares solitários diminui a capacidade do nucleófilo de atacar.
OH -> CH 3 COO - O íon acetato é pior nucleofílico do que o íon hidróxido devido à deslocalização de carga em ambos os oxigênios.