Les nucléophiles sont des bases de Lewis qui attaquent un carbone, déplaçant le groupe partant. Les nucléophiles ioniques sont courants, mais il existe également de nombreux exemples de nucléophiles neutres. La caractéristique générale de tous les nucléophiles est la présence de paires isolées sur l'atome attaquant.
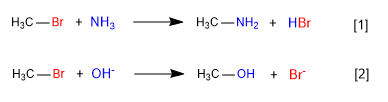
[1 ] Lent
[2 ] Rapide
Dans la première réaction, l'ammoniac agit comme une espèce neutre nucléophile, mais avec des paires isolées sur l'azote, déplaçant le brome du carbone et formant une amine.
Dans la deuxième réaction, l'ion hydroxyde agit comme un nucléophile, déplaçant le brome et formant un alcool. On observe que la première réaction est plus lente que la seconde, en conclusion l'ammoniac est un moins bon nucléophile que l'ion hydroxyde.
La capacité d'un nucléophile à attaquer un substrat est connue sous le nom de nucléophilie. La nucléophilie dépend de plusieurs facteurs : la position de l'atome attaquant dans le tableau périodique, la charge et la résonance.
Charge - Les espèces chargées sont de meilleurs nucléophiles que les neutres
OH ->> H 2 O ion hydroxyde (espèce chargée) meilleur nucléophile que l'eau (espèce neutre)
NH 2 ->> NH 3 ion amide (espèce chargée) meilleur nucléophile que l'ammoniac (espèce neutre)
PH 2 ->> PH 3 ion phosphure (espèce chargée) meilleur nucléophile que phosphine (espèce neutre)
Position sur le tableau périodique - La nucléophilie augmente en descendant dans le tableau périodique et en se déplaçant vers la gauche.
NH 3> H 2 O l'ammoniac est un meilleur nucléophile que l'eau car l'azote est plus à gauche que l'oxygène
I -> Cl - l'iodure est un meilleur nucléophile que le chlorure car il est plus bas.
PH 3> NH 3 La phosphine est un meilleur nucléophile que l'ammoniac car le phosphore est inférieur à l'azote.
Résonance - La résonance diminue la nucléophilie. La délocalisation des paires isolées diminue la capacité d'attaque du nucléophile.
OH -> CH 3 COO - L'ion acétate est moins nucléophile que l'ion hydroxyde en raison de la délocalisation de la charge sur les deux oxygènes.