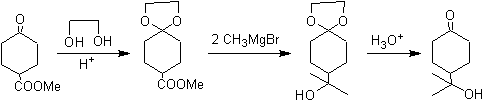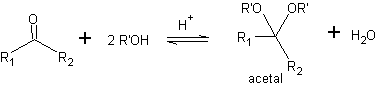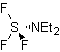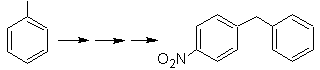SINTESI ORGANICA
- Dettagli
- Wilbertrivera
- SINTESI ORGANICA
- Visite: 45872
METODOLOGIE DI SINTESI ORGANICA
La sintesi totale di un composto organico richiederebbe di partire ogni volta dagli elementi che lo compongono. Tuttavia, è ben noto che dagli elementi si possono ottenere composti organici semplici come urea, metano, metanolo, acetilene, acido acetico, etanolo e così via, si possono costruire strutture sempre più complesse.
Tuttavia, ciò non è né pratico né necessario in quanto esiste un gran numero di composti organici disponibili in commercio o economicamente disponibili e questi possono essere utilizzati come materiali di partenza. A rigor di termini, tutte derivano dagli elementi che le compongono o possono essere derivate da esse, quindi qualsiasi sintesi che si intraprende a partire da queste materie prime sarà “formalmente” una sintesi totale.
Le metodologie di sintesi per affrontare una sintesi di successo sono cambiate con il passare del tempo e lo sviluppo della chimica stessa come scienza, quindi sono noti i seguenti:
- Metodologia della “associazione diretta”
- Metodologia dell'“approccio intermedio”
- Metodologia di "analisi logica"
- Dettagli
- Wilbertrivera
- SINTESI ORGANICA
- Visite: 30409
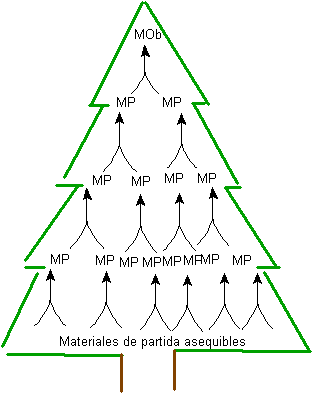
L'elaborazione di un " albero di sintesi " basato sulla generazione di molecole intermedie o precursori, passo dopo passo in direzione antitetica (retrosintesi), cioè partendo dalla molecola obiettivo, costituisce un metodo che può essere meglio compreso considerando i seguenti principi generali di detto processo.
1. Inizia con la struttura finale (MOb). Partendo dalla struttura finale, la molecola bersaglio, lavora a ritroso (retrosintesi) fino ad ottenere materie prime facilmente accessibili. Se la materia prima di partenza è specificata nel problema di sintesi, ciò limita solo il numero di possibili percorsi sintetici da affrontare.
2. Caratterizzazione della molecola bersaglio (MOb ). Quando si esamina la struttura della molecola bersaglio, è necessario rispondere alle seguenti domande:
A. Che tipo di composto è?
B. Quale/i gruppo/i funzionale/i contiene?
C. Qual è la natura dello scheletro di carbonio?
D. La molecola ha una catena alchilica normale o ramificata?
E. Contiene anelli e sono cicloalchilici o aromatici?
F. Il MOb ha una simmetria reale o potenziale?
3. Il Gruppo Funzionale . A tal proposito, sarà bene rispondere anche alle seguenti domande:
A. È nota la reattività, la sensibilità e l'instabilità dei gruppi funzionali che il MOb possiede?
B. Quali metodi generali sono disponibili per la sua preparazione?
C. Quale di essi è applicabile allo specifico gruppo funzionale della molecola problematica?
4. Aspetti stereochimici . Sarà analizzato nel MOb, preferibilmente:
A. centri di chiralità
B. Sagomatura e configurazione degli anelli
C. Effetti di prossimità tra gruppi
5. Lo scheletro di carbonato . Il problema principale nella maggior parte delle sintesi organiche è la costruzione dello scheletro di carbonio. Lo scambio di gruppi funzionali (IGF) è spesso semplice da eseguire, come il chetone con l'alcol, l'aldeide con l'acido o l'alcol con il bromuro. Le domande che vengono poste riguardo alla costruzione dei collegamenti CC sono correlate a quelle che sono già state sollevate riguardo al gruppo funzionale.
A. Alcuni dei metodi disponibili per formare gruppi funzionali sono applicabili per generare collegamenti CC?
B. Il metodo è compatibile con lo specifico scheletro di carbonio della molecola target? Se non è.
C. Esiste una procedura per formare una catena di carbonio che produca una funzione convertibile in quella richiesta?
6. Molecole Precursori (PM)
L'analisi della struttura della molecola problematica e la considerazione delle domande poste nei passaggi da 1) a 5), daranno origine a due possibili tipi di molecole precursori. Uno di essi contiene un gruppo funzionale equivalente a quello della struttura finale.
L'altro è un composto con meno atomi di carbonio rispetto alla molecola bersaglio. Quando questi ultimi vengono riuniti, si ottiene la catena di carbonio finale e la funzionalità richiesta.
La generazione di uno qualsiasi di questi tipi di molecole precursori dovrebbe comportare una semplificazione del problema.
In generale, se un percorso proiettato porta a precursori più difficili da sintetizzare rispetto al problema stesso (target), occorre cercare un altro percorso.
Fig. 1. ALBERO DI SINTESI
La generazione di molecole precursori, fino a raggiungendo i materiali di partenza, genera una serie di strutture, che insieme formano una specie di albero, fig.1. Da qui deriva il nome del metodo sintetico.
Leggi tutto: Principi generali del metodo dell'albero di sintesi
- Dettagli
- Wilbertrivera
- SINTESI ORGANICA
- Visite: 36772
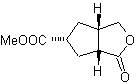
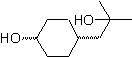
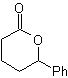
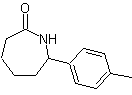
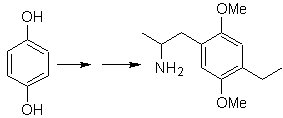
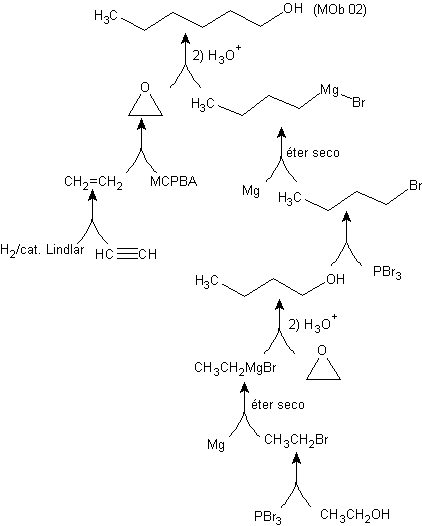
Sintesi di n-esanolo ( MOb 02)
Soluzione : n-Esanolo (MOb 02) è un alcol primario, la cui catena di carbonio non ha ramificazioni. Pertanto, la strategia si riduce alla ricerca di reazioni che permettano alla catena di crescere in un buon numero di atomi di carbonio. Non è consigliabile che la crescita della filiera avvenga una ad una, poiché questo percorso porterebbe ad un piano di sintesi con molte fasi, di conseguenza una bassa resa.
Pertanto, l'apertura di anelli epossidici da parte di un composto di Grignard può essere adeguata a questo scopo; in quanto può essere abbinato anche alla sintesi acetilenica (utilizzo di derivati dell'acetiluro di sodio e successiva saturazione del triplo legame).
L'epossido necessario per combinarsi con il Grignard è preparato da un alchene e un acido peracido. Pertanto, si deduce il presente piano di sintesi, in cui i materiali di partenza possono essere acetilene e l'etanolo.
Leggi tutto: Problemi di sintesi, risolti con il metodo dell'albero di sintesi
- Dettagli
- Wilbertrivera
- SINTESI ORGANICA
- Visite: 42642
Formazione di enoli ed enolati
Il carbonio alfa dei composti contenenti il gruppo carbonilico (aldeidi, chetoni, esteri, dichetoni, diesteri, nitrati, nitrili, ecc.), è il centro di molte reazioni di formazione del legame CC. A causa dell'acidità dell'H a , subiscono una -deprotonazione in presenza di una base opportuna, con la conseguente formazione di un carbanione. La risultante carica negativa su C a fino a C=O è stabilizzata per risonanza dallo stesso gruppo carbonilico.
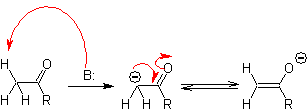
La scelta della base, per la formazione degli enolati, è subordinata al fatto che il pKa dell'acido coniugato della base deve essere maggiore di almeno tre unità del pKa del composto carbonilico che ha gli H acidi .
| pK a = 20 | MeO- pK a = 15 | Formazione di enolato sfavorevole |
| pK a = 10 | tBuO- _ pK a = 19 | Formazione di enolato molto favorevole |
Formazione di enolati:
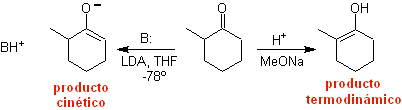
¨ L'enolato cinetico
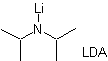
Si verifica perché il substrato ha H α , facilmente accessibile per la deprotonazione attraverso una base tipica come LDA (pKa
ca 30) LDA (litio diisopropilammide) è una base forte, non nucleofila, stericamente impedita. |
|
¨
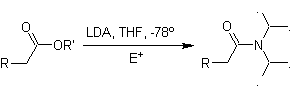
Enolati di esteri:
Gli esteri sono suscettibili a una reazione di sostituzione per la base, LDA può essere problematico, motivo per cui la base non nucleofila (litio isopropilcicloesilammide) viene utilizzata con gli esteri.
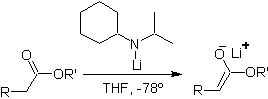
¨
Enolato termodinamico:
Una deprotonazione reversibile può portare a enolati più stabili, che si verifica quando si ottiene il C=C più sostituito della forma enolica.
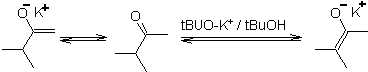
Le condizioni tipiche per la formazione di enolati termodinamici sono: RO-M+ in ROH come solvente protico (pKa di ROH = 15-18).
Gli enolati cinetici e termodinamici possono essere intrappolati, isolati, separati e purificati per ottenere enolati regiochimicamente puri. Ciò può essere ottenuto mediante la formazione di acetati di enolo e sililene etere.
- Dettagli
- Wilbertrivera
- SINTESI ORGANICA
- Visite: 47250
Reazioni di enoli ed enolati
Reazioni aldoliche e cosiddette reazioni di condensazione di composti carbonilici e altre di questo tipo, che possono formare strutture enoliche ed enolate, partecipano a un ampio gruppo di reazioni importanti che ci permettono di comprendere l'esistenza di un numero immenso di molecole risultanti dall'interazione di enoli o enolati con una serie di gruppi elettrofili.
Lo studio di questo tipo di reazioni ha permesso di verificare e stabilire l'esistenza di due meccanismi di reazione attraverso i quali si verificano, come spiegato di seguito:
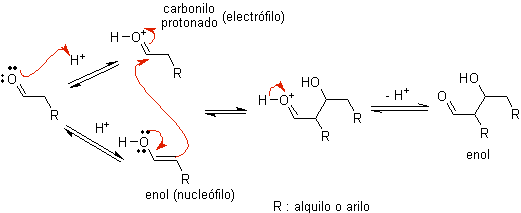
A)
Quando l'acido viene utilizzato come catalizzatore, il composto carbonilico viene inizialmente protonato e quindi tautomerizzato nella sua forma enolica , che è un nucleofilo sul carbonio alfa del gruppo carbonilico. Lo stesso mezzo acido è sufficiente per attivare il gruppo carbonilico di un'altra molecola, rendendolo altamente elettrofilo, che genera condizioni ottimali per produrre un composto carbonilico insaturo.
La reazione procede normalmente fino alla disidratazione dell'enolo formatosi, catalizzata dallo stesso acido della reazione.
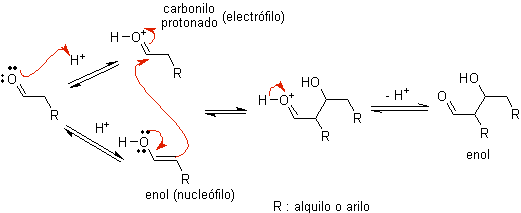
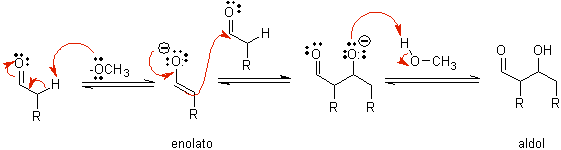
B) Quando il catalizzatore è una base, come un alcossido, la reazione di tipo aldolico procede attraverso l'attacco nucleofilo dell'enolato stabilizzato per risonanza sul gruppo carbonilico di un'altra molecola.
Per disidratazione dell'aldolo, catalizzata dalla base, si forma il prodotto finale disidratato.
Come nel caso precedente, la disidratazione base-catalizzata (a volte scritta come un singolo passaggio), permette di controllare la reazione e produrre un prodotto finale disidratato. In alcuni casi, la formazione di enolati è irreversibile.
come appare in alcuni casi è richiesta solo una quantità catalitica di base, la procedura più comune consiste nell'utilizzare una quantità estequiométrica di base forte comeLDA o NaHMDS . In questo caso, la formazione dell'enolato è irreversibile e il prodotto aldolico non si forma finché l'alcossido metallico del prodotto aldolico non viene protonato in una fase successiva.
- Dettagli
- Wilbertrivera
- SINTESI ORGANICA
- Visite: 36652
La sintesi organica, cuore della chimica organica , è un'attività essenzialmente euristica , cioè è un processo in cui si fondono le attività creative altamente predittive del pensiero logico e le procedure empiriche, ricche di elaborazioni artistiche, facendo del chimico organico un vero innovativo.
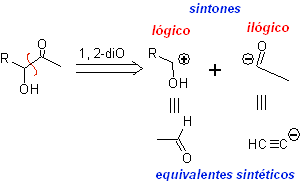
Come ogni metodo, il " metodo della disconnessione o synthon " ha una sua struttura, simbologia e linguaggio, che devono essere inizialmente assimilati e compresi da coloro che sono disposti a utilizzare questo strumento sintetico.
Il metodo di sintesi delle disconnessioni o synthon , include Due fasi;
![]() Fase di analisi retrosintetica . Mostra tutte le trasformazioni che verranno effettuate nel processo di semplificazione della struttura di
Fase di analisi retrosintetica . Mostra tutte le trasformazioni che verranno effettuate nel processo di semplificazione della struttura di
![]() Fase di sintesi . Dove ciò che è "pensiero", basato su criteri di razionalità meccanicistica e reattività dei composti organici, si materializza in un percorso di sintesi, che sarà scritto, come è previsto che avvenga nel laboratorio chimico. È lì che l'esperienza emerge e si manifesta "l' arte di fare o inventare ” del chimico, cioè
Fase di sintesi . Dove ciò che è "pensiero", basato su criteri di razionalità meccanicistica e reattività dei composti organici, si materializza in un percorso di sintesi, che sarà scritto, come è previsto che avvenga nel laboratorio chimico. È lì che l'esperienza emerge e si manifesta "l' arte di fare o inventare ” del chimico, cioè
IL termini, definizioni o operazioni di sintesi, ricorrenti in questo metodo, sono i seguenti:
Molecola bersaglio (MOb) .
Questo è il nome dato a qualsiasi molecola che deve essere sintetizzata o preparata da materiali semplici ed economici, che in un problema può essere precedentemente definita o adattata alle opzioni che il chimico genera nel suo piano o progetto di sintesi.
trasformazione . ( ![]() ).
).
La speciale freccia di retrosintesi unidirezionale dovrebbe essere intesa come una rappresentazione simbolica dell'espressione " è preparato da " e rappresenta anche una sorta di trasformazione nella struttura di
I tipi di trasformazione a cui si fa riferimento sono in realtà operazioni retrosintetiche quali: Disconnessioni, Riconnessioni, Riarrangiamenti, Interconversione di Gruppi Funzionali (IGF), Addizione di Gruppi Funzionali (AGF), Delezione di Gruppi Funzionali (SGF), ecc.
Disconnessione.
Si tratta di un'operazione retrosintetica che rappresenta la rottura immaginaria dei legami chimici che si sarebbero formati nella molecola bersaglio, dai sintoni o più precisamente dai loro equivalenti sintetici (molecole precursori), postulati.
Può essere inteso come l'inverso di una reazione chimica, è rappresentato da una freccia (molto diversa da quella di una reazione chimica o delle condizioni di equilibrio) e da una linea ondulata incrociata sopra il legame che verrà "scollegato".
È anche possibile posizionare la disconnessione proposta sulla freccia: CC, CS. CX, CO, CN. ecc. Espressioni che ci legano al tipo di reazione che verrà utilizzata, nella formazione di
In altri casi, il modello di disconnessione utilizzato può essere scritto, ad esempio, è comune trovare: 1, 3-diO, 1,4 –diCO, 1,5-diCO o α, β -insatCO . Eccetera.
Pertanto, in una molecola diossigenata, ci si può aspettare che si verifichino le seguenti disconnessioni:
![]() disconnessioni eterolitiche,
disconnessioni eterolitiche,
![]() Disconnessioni omolitiche o radicali
Disconnessioni omolitiche o radicali
![]() Disconnessioni elettrocicliche
Disconnessioni elettrocicliche
![]() Riordina disconnessioni
Riordina disconnessioni
Leggi tutto: IL METODO DELLE DISCONNESSIONI O DELLA SINTONIA
- Dettagli
- Wilbertrivera
- SINTESI ORGANICA
- Visite: 28572
DISCONNESSIONI DEI COMPOSTI 1,3-DIOSSIGENO
I composti organici ossigenati sono i più abbondanti in natura e in particolare i diossigenati, motivo per cui molti ricercatori chimici hanno modellato la disconnessione retrosintetica di queste molecole, un aspetto che verrà studiato nei paragrafi seguenti.
Per cominciare, i modelli di disconnessione delle molecole diossigenate sono stati divisi in due grandi gruppi, in base alla natura dei sintoni che si generano con l'applicazione alla molecola da sintetizzare di un'operazione sintetica di base chiamata " DISCONNESSIONE" e che generalmente è indicato come una molecola bersaglio (MOb) .
Questi grandi gruppi sono:
![]() Modelli di disconnessione “ logici ”, e
Modelli di disconnessione “ logici ”, e
![]() Modelli di disconnessione “ anomali ” o “ illogici ”.
Modelli di disconnessione “ anomali ” o “ illogici ”.
I cosiddetti modelli di disconnessione "logica" sono quelli che, applicando una "disconnessione" di uno o più legami chimici in
Composti classificabili come 1,3-diossigeno e 1,5-diossigeno, quando sottoposti a retrosintesi, generalmente formano sintoni considerati "logici". D'altra parte, le molecole organiche legate a 1,2-diossigenato, 1,4-diossigenato e 1,6-diossigenato, generano sintoni
considerato “illogico”
Modello cut-off 1,3-diossigeno
![]() Composti β-dicarbonilici
Composti β-dicarbonilici
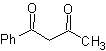
I composti 1,3-dicarbonilici si ottengono con buone rese mediante reazioni di condensazione di tipo Claisen, che prevedono la reazione tra esteri e composti con idrogeni attivi, quali: esteri, chetoni, aldeidi, nitrili, nitroderivati e alcuni idrocarburi in presenza di reagenti alcalini.
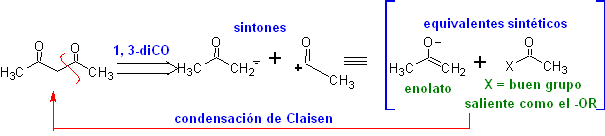
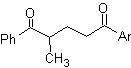
I β-dichetoni e le β-chetoaldeidi sono ottenuti per condensazione di Claisen incrociata, utilizzando un chetone ed un estere adatti. Nella condensazione di Claisen incrociata di chetoni ed esteri si ottengono buone rese perché i chetoni sono notevolmente più acidi degli esteri, quindi, nell'ambiente basico, il chetone è deprotonato in misura maggiore dell'estere.
Esempi : Proponi un progetto di sintesi da materiali semplici, per le seguenti molecole:
MOb 16
| folla 17
| MOb 18
|
Soluzione:
MOb 16 . Apparentemente le due alternative di disconnessione (a) e (b), mostrate in
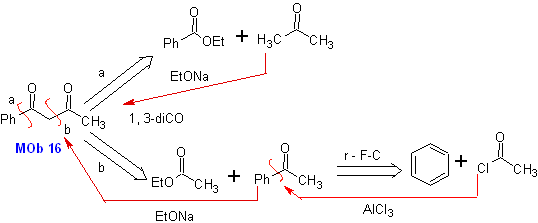
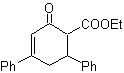
Tuttavia, l'alternativa (b) risulta essere la più adatta, in quanto, nel mezzo di reazione basico, il carbanione formatosi PhCOCH 2 - sarebbe meglio stabilizzato, a causa della risonanza e degli effetti induttivi.
- Dettagli
- Wilbertrivera
- SINTESI ORGANICA
- Visite: 25922
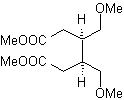
I composti 1,5-diossigenati sono generalmente il risultato di reazioni di addizione coniugata di nucleofili da composti carbonilici, con H α acidi (enoli, enolati, enammine, ecc.), nonché nitrili e nitrati, su substrati alfa beta insaturi rispetto a gruppi carbonilici e simili, nota come reazione di Michael, con opzioni complementari essendo la reazione di Nef e la reazione di annullamento (annulazione) di Robinson.
Disconnettere modello 1, 5 diossigeno (1,5-diO)
Il modello di disconnessione 1,5-diO può essere applicato, dopo la necessaria funzionalizzazione, a composti quali: 1,5-diidrossili, 1,5-idrossialdeidi, 1,5-idrossichetoni, 1,5-idrossiesteri, 1,5- chetoaldeidi, 1,5-dichetoni, 1,5-chetoesteri, 1,5-dialdeidi, ecc.
Le possibilità aumentano se si prendono in considerazione anche nitroderivati e nitrili, che possono formare carbanioni molto reattivi in un mezzo basico in grado di addizionarsi a composti carbonilici α,β-insaturi per ottenere prodotti di tipo 1,5-diO.
L' analisi fondamentale della disconnessione dei composti 1,5-diO è la seguente:
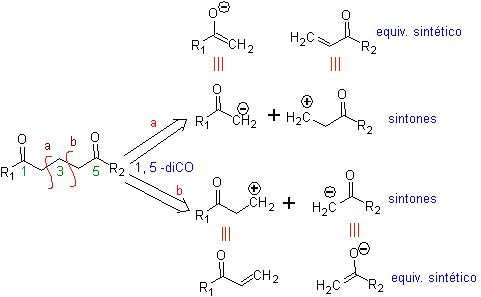
La scelta della disconnessione (a) o (b), attorno a C3, dipenderà dalla natura dei gruppi R1 e R2, che possono conferire maggiore o minore stabilità al sintone o equivalente sintetico necessario per la formazione di
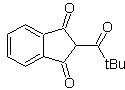
Proporre un progetto di sintesi per MOb 29, 30 e
MOb 29
| MOb 30
| MOb 31
|
Soluzione:
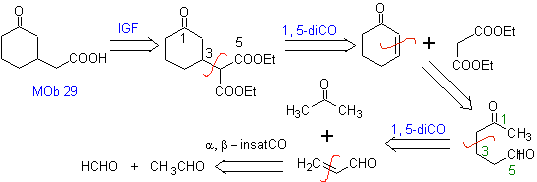
MOb 29 . Analisi retrosintetica: il carbanione doveva essere aggiunto al composto a , b -insaturo CO Può essere ottenuto da dietil malonato in un terreno basico. Che successivamente forzerà una decarbossilazione, da raggiungere
- Dettagli
- Wilbertrivera
- SINTESI ORGANICA
- Visite: 65711
L'operazione di protezione richiede la seguente procedura:
·
Proteggere i gruppi funzionali più reattivi in modo selettivo e in condizioni blande.
·
Eseguire la reazione sul gruppo funzionale richiesto senza influenzare il gruppo protetto
·
Gruppo funzionale non protetto, sottoposto a protezione
IL l'azione di protezione deve soddisfare i seguenti requisiti fondamentali:
·
La reazione deve funzionare bene ed essere chemoselettiva.
·
Il nuovo gruppo funzionale deve essere stabile nelle condizioni di reazione del gruppo che reagirà.
·
La funzionalità introdotta non deve aggiungere centri chirali alla molecola che possono generare diasteromeri
·
Il gruppo funzionale originale deve poter essere rigenerato con buona resa e senza intaccare il resto della molecola.
L'uso di protettori dovrebbe essere ridotto al minimo indispensabile e la loro scelta dovrebbe essere tale da non dover essere sostituiti durante tutta la sintesi, poiché le fasi di introduzione e rimozione (deprotezione) aggiungono costi e lavoro alla sintesi e diminuiscono la resa. Esempio.
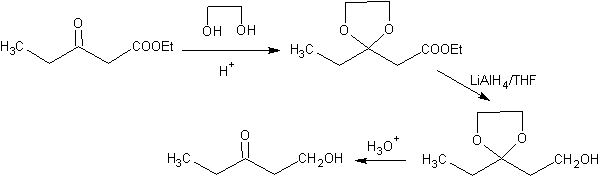
Il gruppo chetonico della molecola è stato protetto trasformandolo in un chetale ciclico, con un etandiolo in ambiente leggermente acido, successivamente questa molecola è stata fatta reagire con due moli di fenilmagnesio bromuro, che agisce sul gruppo estere, per trasformarlo in un alcol terziario, con due sostituenti metilici apportati dal Grignard. Infine, il chetale ciclico viene idrolizzato per rigenerare il chetone.
In pratica non esiste un gruppo di protezione perfetto per ogni funzionalità, si può invece affermare che esiste un'ampia batteria di possibili protettori, ciascuno dei quali soddisfa le condizioni di cui sopra in determinate circostanze. Un breve elenco di protezione dei gruppi più comuni è incluso nelle seguenti sezioni:
PROTEZIONE DA ALDEIDI E CHETONI
Un modo per proteggere chetoni e aldeidi è la loro conversione in acetali. Gli acetali possono essere deprotetti in condizioni blande mediante reazioni di idrolisi acida.
Nella riduzione di un chetoestere a chetoalcol. La protezione del chetone sotto forma di un acetale è molto conveniente poiché l'acetale resiste alle condizioni riducenti nelle quali sarà usato nella conversione del gruppo estere in un gruppo ossidrile.
Lo schema seguente mostra la sequenza di sintesi completa che consente di ottenere la riduzione dell'estere senza intaccare il chetone:
Nella prima fase, il chetone viene convertito in un acetale ciclico mediante reazione con glicole etilenico in presenza di un catalizzatore acido. Nella seconda fase, l'estere viene ridotto con LiAlH 4 . Questo reagente non attacca l'acetale. Infine, nella terza fase, l'alcool-acetale viene trattato in un mezzo acido acquoso. In queste condizioni l'acetale viene idrolizzato, rigenerando il gruppo carbonilico chetonico. Ciascuno dei tre stadi è chemoselettivo poiché in ognuno di essi si ottiene la reazione preferita di un gruppo funzionale.
in presenza di un altro.
Leggi tutto: Protezione dei gruppi funzionali nella sintesi organica
- Dettagli
- Wilbertrivera
- SINTESI ORGANICA
- Visite: 29461
Il controllo nella sintesi organica è uno dei compiti più importanti per ottenere la trasformazione richiesta o pianificata. e/o da evitare la formazione di quei sottoprodotti che compromettono sostanzialmente lo sviluppo ottimale della sintesi organica in questione. Parimenti, da una prospettiva più generale, il controllo può includere o coprire anche gli aspetti di simmetria e selettività.
Quindi, il controllo dovrebbe essere inteso come una serie di operazioni sintetiche che consentono al chimico di formare lo scheletro di carbonio con la funzionalità prevista o di "collocare" un gruppo o un atomo nel luogo o nella posizione richiesta.
Di conseguenza, queste operazioni possono essere di una vasta gamma di routine con un'intenzione riflessa dal chimico e che richiedono determinate capacità e abilità cognitive simili a quelle artistiche, per la costruzione (sintesi) di molecole organiche.
Pertanto, nelle reazioni di condensazione, come in altre, le operazioni di controllo possono essere incluse in una delle seguenti categorie.
![]() Reazioni concorrenti (autocondensazione e/o condensazione incrociata)
Reazioni concorrenti (autocondensazione e/o condensazione incrociata)
![]() Attivazione – disattivazione
Attivazione – disattivazione
![]() Selettività e specificità
Selettività e specificità
![]() Protezione-deprotezione
Protezione-deprotezione
Nelle reazioni di condensazione dei composti carbonilici è fondamentale stabilire in anticipo l'ordine degli eventi per minimizzare o, se necessario, sopprimere le possibilità di autocondensazione e il verificarsi di condensazione incrociata, che purtroppo rappresentano una minaccia evidente in queste reazioni .
autocondensazione
Tutti i composti carbonilici che hanno uno o più idrogeni alfa, sui carboni adiacenti al gruppo carbonilico, corrono il rischio di subire una reazione di autocondensazione se non si segue il corrispondente rigore.
Così, per esempio, se una base non idrossilata come EtONa viene aggiunta a un 2-butanone, si formerà un enolato che potrebbe eventualmente combinarsi con un'altra molecola dello stesso chetone. Allo stesso modo, se si aggiunge H+, può verificarsi anche l'autocondensazione, come si può vedere nel seguente schema: Questo può essere minimizzato aggiungendo alla stessa velocità, da alimentatori separati, la base o l'acido al composto che fornirà l'enolo o enolato e il composto carbonilico che sarà attaccato sul carbonio carbonilico . È possibile utilizzare un pallone a tre colli e l'agitazione magnetica.
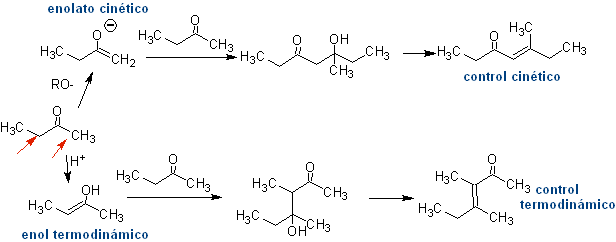
condensazione incrociata
Idealmente, nelle reazioni di condensazione di composti carbonilici, una delle molecole reagenti dovrebbe enolizzarsi rapidamente, mentre l'altra dovrebbe preferibilmente non avere Hα. , per garantire che non si formino altri sottoprodotti
La retrosintesi che si analizza di seguito è un buon esempio di quanto precedentemente indicato.
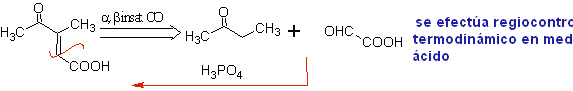
Leggi tutto: Controllo della condensazione dei composti carbonilici
- Dettagli
- Wilbertrivera
- SINTESI ORGANICA
- Visite: 26621
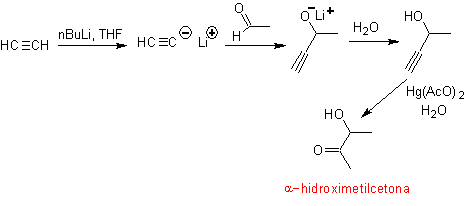
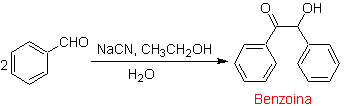
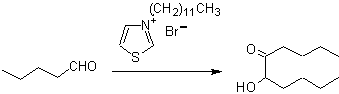
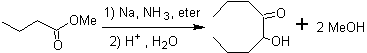

- Dettagli
- Wilbertrivera
- SINTESI ORGANICA
- Visite: 26947
DISCONNESSIONE DEI COMPOSTI 1,4-DIOSSIGENO
Un altro gruppo di composti di grande importanza nella sintesi chimica è costituito dalle molecole diossigenate che si trovano in un rapporto di distanza di 1,4. Questi composti, se sottoposti ad un'analisi di disconnessione retrosintetica, generano sintoni, dove uno di essi, l'elettrofilo o il nucleofilo, può essere considerato "anomalo" o "illogico", perché la carica assegnata a uno degli atomi non può essere spiegata in termini della sua elettronegatività intrinseca o indotta.
1. Composti 1,4-diossigeno (1,4-diO)
In questo tipo di composti la disconnessione porta anche ad un sintone logico e ad un altro sintone illogico (non naturale), che può essere un nucleofilo o un elettrofilo, il cui equivalente sintetico deve ancora essere adeguatamente rielaborato, per poter essere utilizzato in la reazione chimica.
1. 1. Composti 1,4-dicarbonile
1.1.1. Composti 1,4-dichetonici
Le alternative di disconnessione di questo tipo di composti o molecole da sintetizzare (MOb), possono portare alle seguenti opzioni:
A. Un sintone anione logico e un sintone cationico illogico
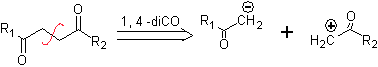
L'equivalente sintetico dell'anione è lo ione enolato o l'enolo stesso del composto carbonilico. Invece l'equivalente sintetico per il carbocatione è alfa alocarbonile. (Ampololungo)
B. Un sintone logico cationico e un sintone anione illogico
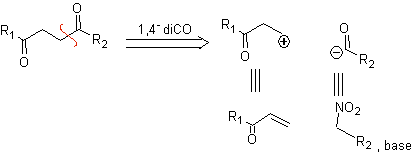
L'equivalente sintetico del sintone cationico logico è il composto carbonilico α,β-insaturo. Un adatto equivalente sintetico per il sintone anionico può essere un anione nitroalcano. Il gruppo –NO 2 negli alcani può essere trasformato in C=O, mediante la reazione di Nef, oppure mediante le varianti della reazione di McMurry, dove per azione del TiCl 3, il nitroalcano si trasforma in un'immina, che è quindi viene idrolizzato in un mezzo acido nel rispettivo composto carbonilico.
1.1.2.
Composti 1,4-chetoesteri
γ-chetoesteri, 1,4-diesteri e 1,4-diacidi possono essere scollegati a un sintone cationico naturale, il cui equivalente sintetico è un composto carbonilico α,β-insaturo, e al composto non naturale ("illogico" ) anione synthon (-) COOR, il cui equivalente sintetico è lo ione cianuro.
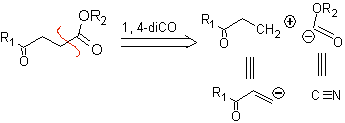
Esempi: proporre un progetto di sintesi, a partire da materiali semplici ed economici, per ciascuna delle seguenti molecole:
MOb 35
| MOb 36
| |
MOb 37
| MOb 38
|
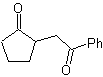
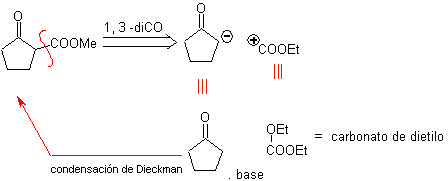
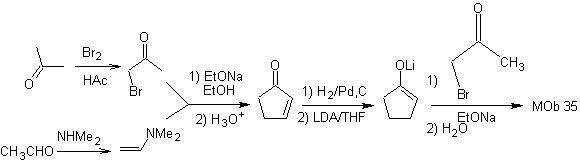
MOb 35 (a). Analisi retrosintetica . La molecola può essere disconnessa secondo il modello 1,4-diCO. Il ciclopentanone precursore generato deve essere precedentemente attivato in modo che il suo Cα sia più nucleofilo, e quindi essere utilizzato nella reazione con α.bromoacetone.
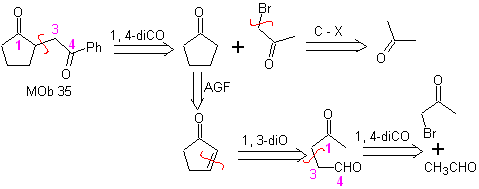 sintesi . La nucleofilia del ciclopentanone è controllata e garantita, utilizzando LDA, per arrivare a
sintesi . La nucleofilia del ciclopentanone è controllata e garantita, utilizzando LDA, per arrivare a
- Dettagli
- Wilbertrivera
- SINTESI ORGANICA
- Visite: 21961
I composti 1,6-difunzionalizzati utilizzano preferibilmente la strategia di riconnessione per la loro rispettiva sintesi; Questa strategia può benissimo essere combinata con la reazione di Diels-Alder, che generalmente produce addotti olefinici a sei membri, o la riduzione di Birch degli anelli benzenici, che genera anch'essa prodotti olefinici a sei membri.
1.
Composti 1,6-diossigenati
La reazione che genera composti dicarbonilici, di diverse possibili combinazioni: dichetoni, chetoacidi, chetoaldeidi, diacidi, ecc. e a diverse distanze tra loro, è senza dubbio la reazione di ozonolisi dei composti olefinici.
A seconda della struttura del substrato e delle condizioni di reazione sull'intermedio di ozonuro formatosi, si otterrà un'enorme diversità di composti come risultato della scissione del doppio legame olefinico. Di questi, quelli che sono in un rapporto 1,6 – diossigenato sono di particolare interesse, come si può dedurre dalla seguente operazione sintetica di “riconnessione”:
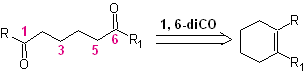
Il modo migliore per comprendere il funzionamento di questa "operazione di riconnessione sintetica" è
sarà ottenuto attraverso la soluzione della sintesi delle seguenti molecole organiche:
MOb 50
| MOb 51
| MOb 52
| ||
MOb 53
| MOb 54
| MOb 55
|
MOb 50 . Analisi retrosintetica : in primo luogo è disconnessa dalla funzione lattone della molecola. Sulla molecola precursore generata, a sua volta, si può sostenere che la sua formazione potrebbe essere avvenuta dall'acido diacarbossilico in posizione 1-6. Che vengono ricollegati per dare origine all'alchene che li ha prodotti per reazione di ozonolisi ossidativa. L'alchene formatosi è un tipico addotto Diels-Alder tra ciclopentadiene e crotonaldeide.
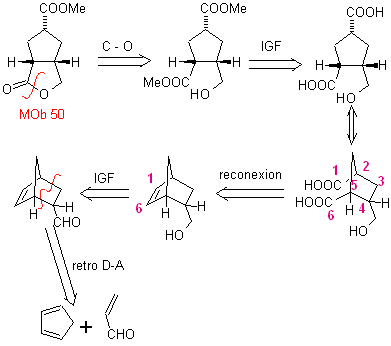
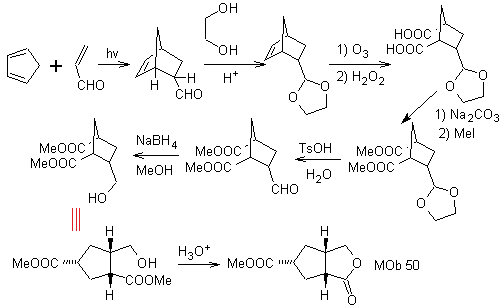
Sintesi: La reazione di Diels-Alder tra ciplopentadiene e l'aldeide α,β-insatura fornisce l'addotto alchenico, per la sua corrispondente apertura per ozonolisi ossidativa, prima di una reazione di protezione del gruppo aldeidico, che viene successivamente deprotetto, da ridurre alla funzione alcolica. Questo alcol reagisce con il gruppo estere in un mezzo acido per formare il lattone desiderato, MOb 50
- Dettagli
- Wilbertrivera
- SINTESI ORGANICA
- Visite: 25684
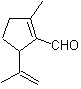
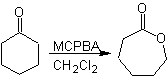
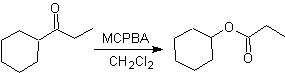
Ossidazione di Baeyer-Villiger
Un'altra reazione che può essere associata alla strategia del La retrosintesi è l'ossidazione dei chetoni da parte dei perossiacidi, meglio nota come reazione di Baeyer-Villiger. Nei chetoni ciclici, l'ossidazione con peracidi genera lattoni. I gruppi attaccati ai chetoni asimmetrici hanno una capacità migratoria, che permette, in termini letterali, di "inserire un atomo di ossigeno" tra il gruppo carbonilico e il gruppo migrante, producendo così un estere o un lattone.
Va tenuto presente che gli enoni (chetoni α, β insaturi) non sono buoni substrati per l'ossidazione di Baeyer-Villiger, perché l'alchene è molto più reattivo del chetone. Tuttavia Esistono strutture speciali in cui l'alchene può essere protetto da un sostituente vicino per effetto sterico e quindi dirigere l'attacco del peracido verso il gruppo carbonilico.
|
|
… |
|
Ricordiamo che l'attitudine migratoria dei diversi gruppi, nella reazione di Baeyer-Villiger, è la seguente:
H> Ph> 3º alchile> cicloalchile> 2º alchile> 1º alchile> Me
Proporre un piano di sintesi per le seguenti molecole:
|
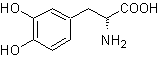
MOb 56
L-dopa |
. |
MOb 57
|
. |
MOb 58
|
|
|
|
|
|
|
|
MOb 59
|
|
MOb 60
|
|
folla 61
|
MOb 56. Analisi retrosintetica. L'amminoacido alfa
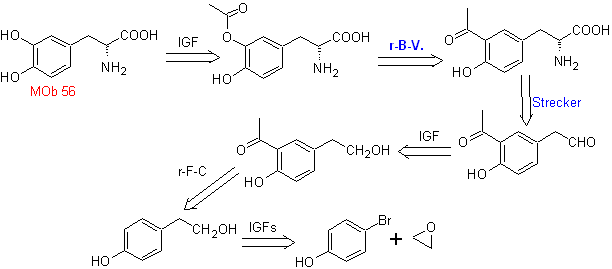
Sintesi. Per Per la formazione del Grignard richiesto, l'orto OH del benzene è protetto. La sintesi di Strecker permette la formazione dell'amminoacido alfa, che viene ossidato secondo Baeyer-Villiger con un peracido e il prodotto subisce idrolisi acida del gruppo estere, che porta alla formazione di
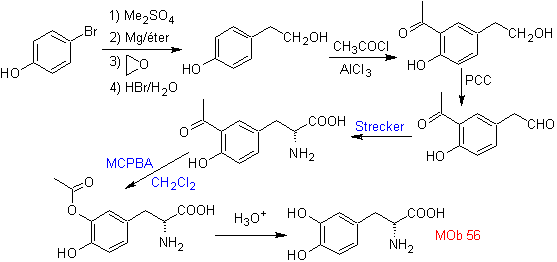
Leggi tutto: L'ossidazione di Baeyer-Villiger come strategia nella retrosintesi
- Dettagli
- Wilbertrivera
- SINTESI ORGANICA
- Visite: 29078
La trasposizione di Beckmann come strategia in
Il riarrangiamento delle ossime in un mezzo acido, chiamato riarrangiamento di Beckman, produce un'ammide o un lattame se il chetone di partenza è rispettivamente lineare o ciclico.
Per migliorare le prestazioni di questo tipo di reazione sono stati studiati vari catalizzatori e mezzi acidi. Così, ad esempio, nuovi mezzi acidi utilizzati come catalizzatori, con lo scopo indicato, sono: TCT/DMF, DAST/CH 2 CL 2 , CF 3 SO 3 H, PCl 5 , HgCl 2 /MeCN e lo ZnO.
TCT: triclorotriazina | …… | DAST: trifluoruro di dietilamminosolfuro |
La fitness migratoria dei gruppi è la stessa della reazione di Baeyer-Villiger. Proponi un progetto di sintesi per ciascuna delle seguenti molecole:
MOb 62 | folla 63 | MOb 64 |
MOb 62 . Analisi retrosintetica.
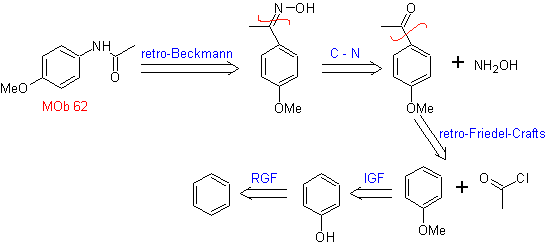
Sintesi. La reazione dell'intermedio chetone aromatico con NH 2 OH e il suo successivo trattamento con una soluzione acquosa di acido solforico e ZnO, permette la formazione del ammide aromatica MOb 62.
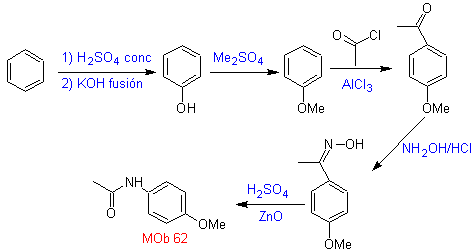
Leggi tutto: Il riarrangiamento di Beckmann come strategia nella retrosintesi
- Dettagli
- Wilbertrivera
- SINTESI ORGANICA
- Visite: 21262
Altre strategie di sintesi che utilizzano sintoni “illogici”.
1.
aggiunta di triplo legame
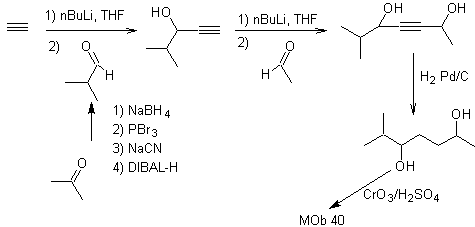
La strategia di "aggiungere" un triplo legame, tra due funzioni ossigenate in posizione 1,4, permette di lavorare successivamente con una disconnessione basata sulla chimica degli acetiluri. Per esemplificare questa strategia, vediamo l'elaborazione di un piano di sintesi per
Assalire. 40. Analisi retrosintetica . Un primo IGF in
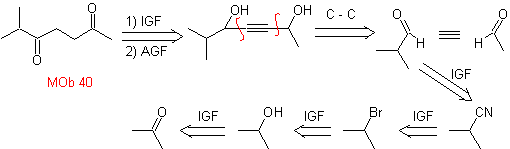
Sintesi. Il diacetilide o acetilide in fasi, si combina con molecole di diverse aldeidi, la molecola intermedia formata viene idrogenata e quindi i suoi alcoli vengono ossidati al composto dichetonico Mob 40.
I γ-lattoni possono anche essere preparati in modo analogo, come mostrato di seguito:

2.
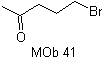
Aggiunta del gruppo COOR come gruppo attivante
L'aggiunta del gruppo COOR, oltre ad attivare il sintone anionico, facilita la disconnessione di una molecola 1,4 diX.
sintetizzare |
|
MOb 41. Analisi retrosintetica.
Leggi tutto: Altre strategie di sintesi che utilizzano syntons "illogici".
- Dettagli
- Wilbertrivera
- SINTESI ORGANICA
- Visite: 51171
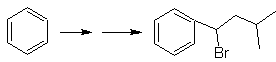
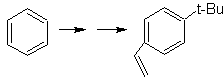
SINTESI DI COMPOSTI AROMATICI I
(Metodo dell'albero di sintesi)
Proporre un piano di sintesi, utilizzando toluene o xilene come materiali di partenza, per le seguenti molecole:
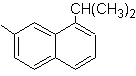
(MOb 12)
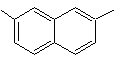
1-isopropil-7-metilnaftalene | (MOb 13)
2,7-dimetilnaftalene |
(MOb 14)
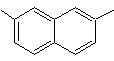
1-isopropil-6-metilnaftalene | (MOb 15)
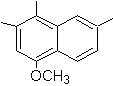
4-metossi-1,2,7-trimetilnaftalene |
Soluzione: (MOb 12).
Nella strategia che si assume si tiene conto che l'ultimo stadio può rispondere ad un processo di "aromatizzazione", per il quale si propone che la molecola precursore presenti un anello non aromatico, con un doppio legame.
sul carbonio contenente il doppio legame e il gruppo alchilico.
Questa struttura può essere ottenuta mediante l'azione di un Grignard su un carbonile e la successiva disidratazione dell'alcool formatosi. Il chetone è formato dall'acilazione sul composto benzenico appropriato con anidride succinica e le sue successive chiusure di acilazione intramolecolare di Friedel-Crafts.
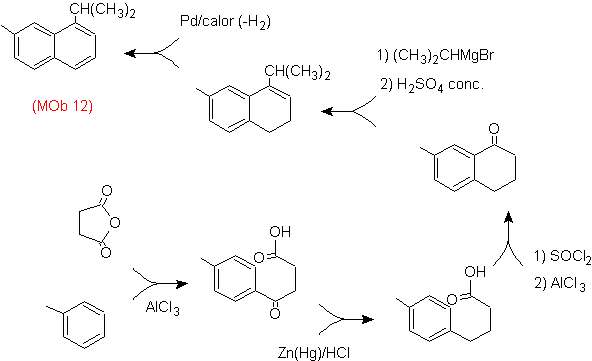
Soluzione (MOb 13).
Ancora una volta, la molecola precursore deve essere "aromatizzata", la strategia più appropriata tra le altre Si basa sulla combinazione di acilazione con anidride succinica sostituita e riduzione di Clemmensen.
Il carbonile finale viene ridotto ad alcol che verrà poi disidratato con idrogeno molecolare e un catalizzatore chiamato rame cromilico.
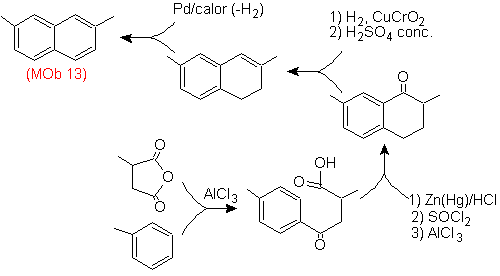
- Dettagli
- Wilbertrivera
- SINTESI ORGANICA
- Visite: 29128
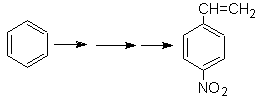
SINTESI DI COMPOSTI AROMATICI II
(Metodo dell'albero di sintesi)
Sebbene uno dei primi problemi da risolvere nella sintesi di composti aromatici multisostituiti sia il controllo degli effetti di orientazione e la formazione di isomeri indesiderati, è importante studiare anche la reattività degli areni, poiché ad un certo punto della senso della presenza di gruppi alifatici nel composto aromatico, molte volte, presentano caratteristiche e reattività, tipiche del tipo di composto organico a cui appartengono e quelle particolari che risultano dalla mutua interazione dei gruppi alifatici e aromatici.
Su questo scopo, si basa, il sintesi delle molecole n. 20 a 27, questa volta da materiali specificati, quindi la domanda è presentata come segue: quali sono le reazioni che Giustificare le seguenti trasformazioni?
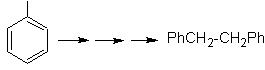
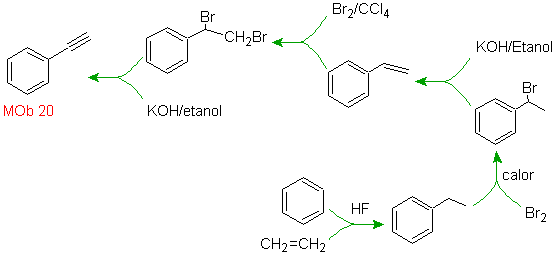
Mob 20 soluzione.
Sappiamo quindi che non esiste alcuna possibilità che lo ione acetiluro agisca direttamente sul benzene il triplo legame è ottenuto da un gruppo alchilico
vec-dibromurato, che si ottiene per bromurazione dello stirene, precedentemente ottenuto per deidrobromurazione di un alogenuro di benzile formato da una bromurazione mediante il meccanismo dei radicali liberi su etilbenzene
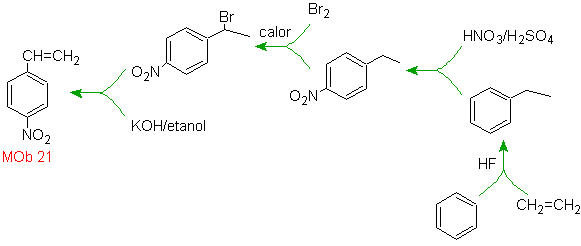
Soluzione Mob 21.
Il paranitrostirene non può essere ottenuto per nitrazione diretta dello stirene, perché il gruppo etenile attaccato all'anello è instabile in condizioni di nitrazione.
Come tale, la molecola precursore avrà un gruppo che è facile da deidrobromurare. Questo precursore si ottiene per bromurazione radicalica del gruppo etilico legato all'anello benzenico, precedentemente nitrato principalmente in posizione para.
- Dettagli
- Wilbertrivera
- SINTESI ORGANICA
- Visite: 32402
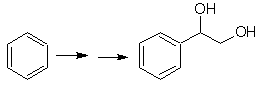
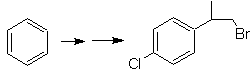
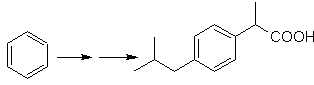
SINTESI DI ALCOLI
(Metodo dell'albero di sintesi)
Proporre un piano di sintesi per le molecole bersaglio indicate dalle singole molecole indicate (MOb 30 -41). Per fare questo, usa i reagenti e le condizioni di reazione che ritieni necessari:
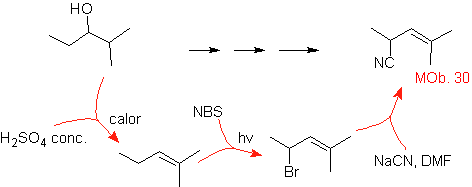
Soluzione MOb 30.
Strategia: si osserva che la molecola di partenza è stata disidratata e nella posizione allilica inizialmente non sostituita, un idrogeno è stato spostato dal gruppo ciano o nitrile. Quest'ultima reazione può avvenire solo se la molecola precursore è un alogenuro allilico, motivo per cui si propone come precursore di
Il Br viene introdotto nella posizione desiderata con l'NBS e l'alchene è il prodotto della disidratazione della molecola di partenza.
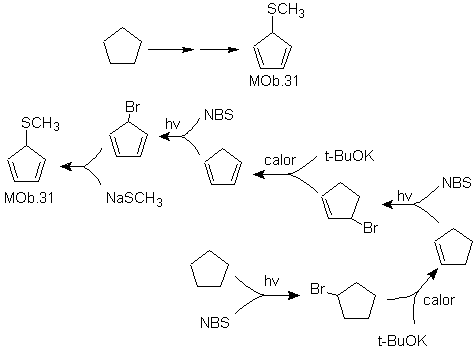
Soluzione MOb 31.
Strategia : è uno zio etere, la molecola precursore necessaria sarà un alogenuro di 1,3-ciclopentadiene.
Questo alogenuro viene preparato per azione dell'NBS sul cicloalchene dienico, che a sua volta viene preparato dalla deidrobromurazione della molecola precursore, che viene raggiunta dall'azione dell'NBS sul cicloalchene formatosi. precedentemente mediante deidroalogenazione della molecola di partenza bromurata dai radicali
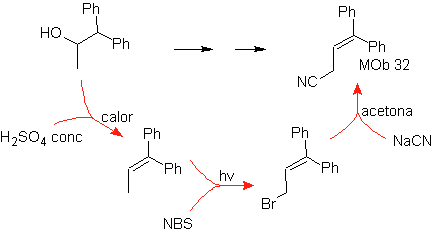
Soluzione Mob 32.
Strategia : è simile a quella utilizzata per ottenere
- Dettagli
- Wilbertrivera
- SINTESI ORGANICA
- Visite: 24933
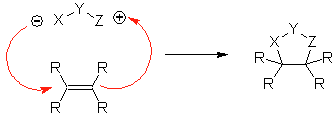
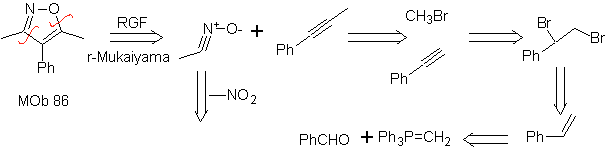
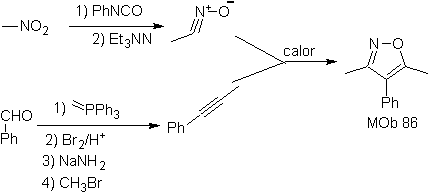
Queste reazioni formano normalmente anelli eterociclici a cinque membri, per i quali è necessaria la reazione tra un composto n1,3 dipolare e un alchene. La reazione è una [3-2] cicloaddizione. I composti 1,3-dipolari che hanno avuto il maggior utilizzo per formare eterocicli pentagonali sono:
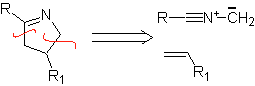 | 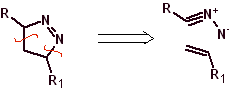 |
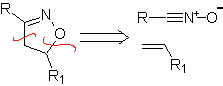 | 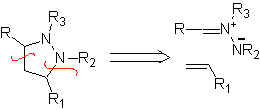 |
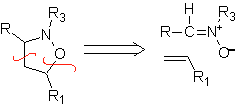 | 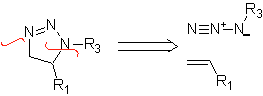 |
| MOb: 86
| . | MOb: 87 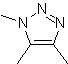 | .. | MOb: 88 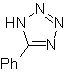 |
Leggi tutto: Sintesi di eterocicli mediante ciclizzazione intermolecolare