Ossidazione di Baeyer-Villiger
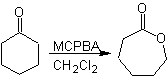
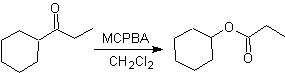
Un'altra reazione che può essere associata alla strategia del La retrosintesi è l'ossidazione dei chetoni da parte dei perossiacidi, meglio nota come reazione di Baeyer-Villiger. Nei chetoni ciclici, l'ossidazione con peracidi genera lattoni. I gruppi attaccati ai chetoni asimmetrici hanno una capacità migratoria, che permette, in termini letterali, di "inserire un atomo di ossigeno" tra il gruppo carbonilico e il gruppo migrante, producendo così un estere o un lattone.
Va tenuto presente che gli enoni (chetoni α, β insaturi) non sono buoni substrati per l'ossidazione di Baeyer-Villiger, perché l'alchene è molto più reattivo del chetone. Tuttavia Esistono strutture speciali in cui l'alchene può essere protetto da un sostituente vicino per effetto sterico e quindi dirigere l'attacco del peracido verso il gruppo carbonilico.
|
|
… |
|
Ricordiamo che l'attitudine migratoria dei diversi gruppi, nella reazione di Baeyer-Villiger, è la seguente:
H> Ph> 3º alchile> cicloalchile> 2º alchile> 1º alchile> Me
Proporre un piano di sintesi per le seguenti molecole:
|
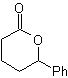
MOb 56
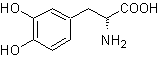
L-dopa |
. |
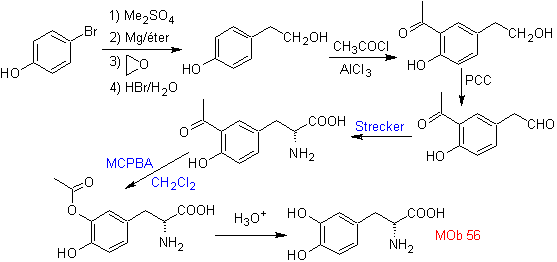
MOb 57
|
. |
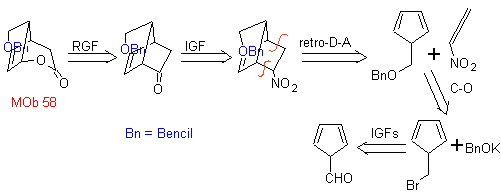
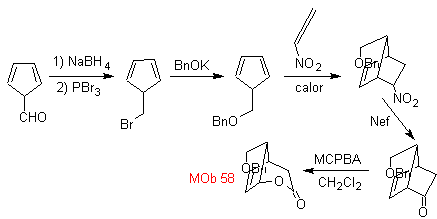
MOb 58
|
|
|
|
|
|
|
|
MOb 59
|
|
MOb 60
|
|
folla 61
|
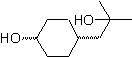
MOb 56. Analisi retrosintetica. L'amminoacido alfa
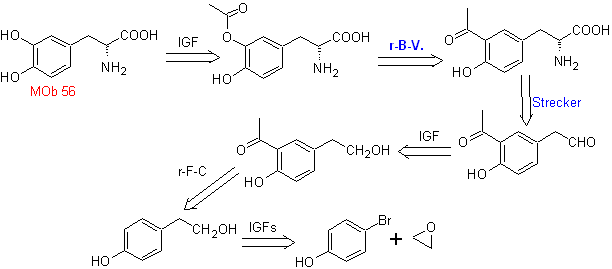
Sintesi. Per Per la formazione del Grignard richiesto, l'orto OH del benzene è protetto. La sintesi di Strecker permette la formazione dell'amminoacido alfa, che viene ossidato secondo Baeyer-Villiger con un peracido e il prodotto subisce idrolisi acida del gruppo estere, che porta alla formazione di
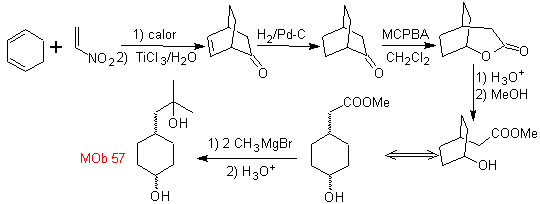
MOb 57
. Retroanalisi
sintetica
._
_
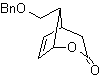
_
Questo MOb è un alcol terziario, quindi può essere preparato da un estere e un eccesso di Grignard.La molecola precursore formata è un composto 1,6-diCO, quindi si ricorre a ricollegarlo in un lattone, che può essere formato da un chetone. Questo chetone biciclico è funzionalizzato con un punto di insaturazione per ottenere una struttura addotta Diels-Alder. Il gruppo carbonile può essere formato da un composto contenente un gruppo nitro, mediante la reazione Nef
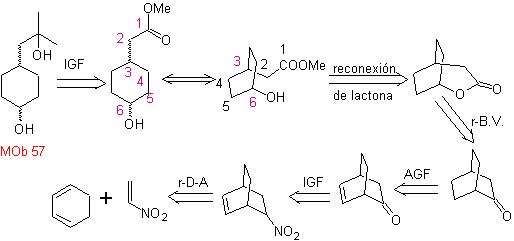
sintesi . Si parte dalla reazione di Diels-Alder di un cicloesadiene e un nitroetilene. L'addotto formatosi viene saturato, per procedere all'ossidazione di Baeyer-Villiger. L'apertura del lattone e l'esterificazione del gruppo acido, forma un intermedio che viene poi trattato con un eccesso di metil bromuro di magnesio, per ottenere
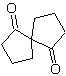
MOb 58. Analisi retrosintetica. Il doppio legame coniugato a un gruppo C=O, presente in
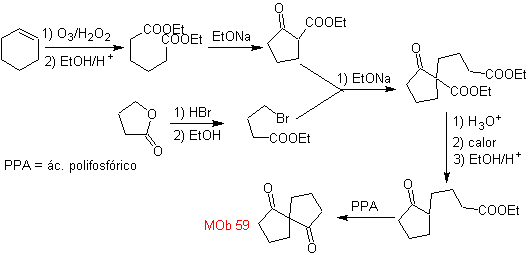
MOb 59 . Analisi retrosintetica. Si procede alla disconnessione
Ancora una volta, viene generato un intermedio o precursore 1,3-diCO che, una volta disconnesso, genera una nuova struttura 1,6-diCO, che ora può essere ricollegata per raggiungere il cicloesene come materiale di partenza.
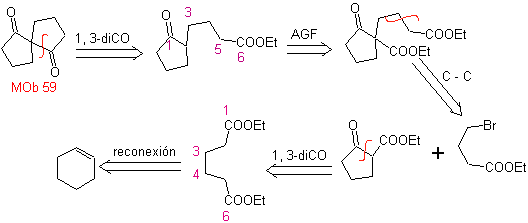
sintesi . L'apertura ossidativa di un cicloesene permette di ottenere la molecola precursore che, dopo aver reagito con il γ-bromoestere, dà origine ad una molecola che, dopo una reazione di Dieckmann, si trasforma facilmente in
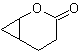
MOb 60 . Analisi retrosintetica. Si presume che la formazione di
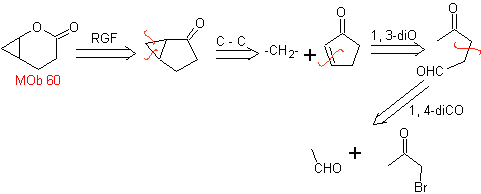
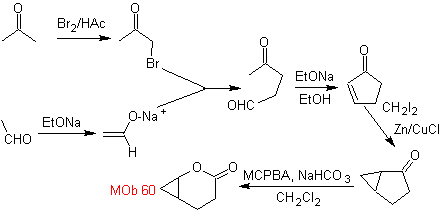
sintesi . L'enolato di acetaldeide si combina con l'α-bromochetone per formare una molecola di 1,4-diCO, che in un mezzo basico e EtOH condensa con la disidratazione per formare un ciclopentanone α,β-insaturo. La reazione di Simonns-Schmidt continua forma ciclopropano e una successiva ossidazione di esso secondo Baeyer-Villiger produce
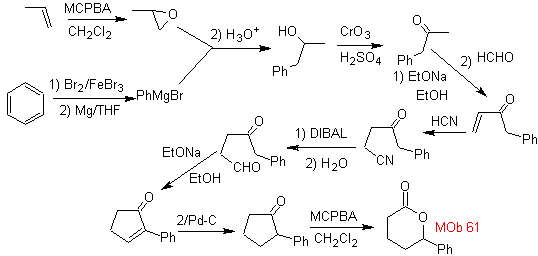
MOb 61 . Analisi retrosintetica . Si presume che
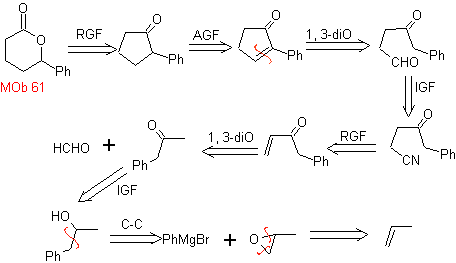
Sintesi. Propene e benzene sono presi come materiali di partenza, la strategia è quella di ridurre il nitrile a CHO con DIBAL in esano, per formare l'intermedio che per annullamento (o annullamento) di Robinson e successiva saturazione, fornisce il ciclopentanone adeguato per essere ossidato dal Baeyer- Procedura di Villiger, per formare