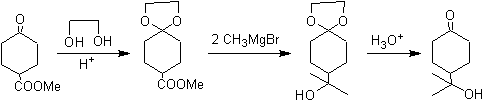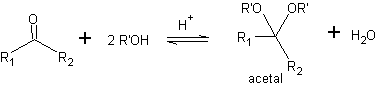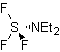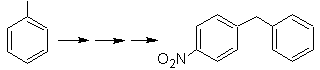ORGANISCHE SYNTHESE
- Details
- Wilbertrivera
- ORGANISCHE SYNTHESE
- Zugriffe: 45347
METHODEN DER ORGANISCHEN SYNTHESE
Die Totalsynthese einer organischen Verbindung müsste jedes Mal von den Elementen ausgehen, aus denen sie besteht. Es ist jedoch bekannt, dass aus den Elementen einfache organische Verbindungen wie Harnstoff, Methan, Methanol, Acetylen, Essigsäure, Ethanol usw. gewonnen werden können und immer komplexere Strukturen aufgebaut werden können.
Dies ist jedoch weder praktikabel noch notwendig, da es eine Vielzahl von organischen Verbindungen gibt, die im Handel oder wirtschaftlich erhältlich sind und als Ausgangsmaterialien verwendet werden können. Streng genommen leiten sich alle von den Elementen ab, aus denen sie bestehen oder abgeleitet werden können, so dass jede Synthese, die aus diesen Rohstoffen unternommen wird, „formal“ eine Totalsynthese ist.
Die Synthesemethoden für eine erfolgreiche Synthese haben sich im Laufe der Zeit und der Entwicklung der Chemie selbst als Wissenschaft geändert, daher sind die folgenden bekannt:
- Methodik der „direkten Assoziation“
- Methodik des „Zwischenansatzes“
- Methodik der "logischen Analyse"
- Details
- Wilbertrivera
- ORGANISCHE SYNTHESE
- Zugriffe: 30427
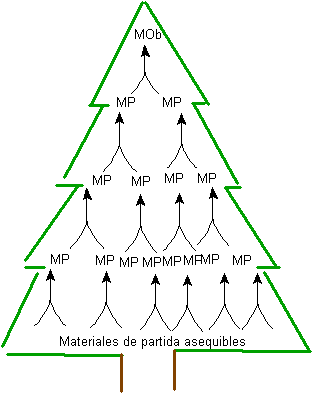
Die Ausarbeitung eines „ Synthesebaums “ auf der Grundlage der schrittweisen Erzeugung von Zwischen- oder Vorläufermolekülen in entgegengesetzter Richtung (Retrosynthese), d. h. ausgehend vom Zielmolekül, stellt eine Methode dar, die besser verstanden werden kann, wenn die folgenden allgemeinen Prinzipien berücksichtigt werden dieses Prozesses.
1. Beginnen Sie mit der endgültigen Struktur (MOb). Ausgehend von der Endstruktur, dem Zielmolekül, wird rückwärts gearbeitet (Retrosynthese), bis leicht zugängliche Rohstoffe erhalten werden. Wenn der Ausgangsrohstoff in der Syntheseaufgabe spezifiziert ist, schränkt dies nur die Anzahl der möglichen Synthesewege ein, die angegangen werden können.
2. Charakterisierung des Zielmoleküls (MOb ). Bei der Untersuchung der Struktur des Zielmoleküls müssen folgende Fragen beantwortet werden:
Zu. Was ist das für eine Verbindung?
B. Welche funktionelle(n) Gruppe(n) enthält es?
C. Was ist die Natur des Kohlenstoffskeletts?
D. Hat das Molekül eine normale oder verzweigte Alkylkette?
Und. Enthält es Ringe und sind sie Cycloalkyl oder aromatisch?
F. Hat das MOb eine tatsächliche oder potentielle Symmetrie?
3. Die Funktionsgruppe . In diesem Zusammenhang ist es auch gut, die folgenden Fragen zu beantworten:
Zu. Ist die Reaktivität, Empfindlichkeit und Instabilität der funktionellen Gruppen, die das MOb besitzt, bekannt?
B. Welche allgemeinen Methoden stehen zu seiner Herstellung zur Verfügung?
C. Welche davon ist auf die spezifische funktionelle Gruppe des Problemmoleküls anwendbar?
4. Stereochemische Aspekte . Es wird im MOb analysiert, vorzugsweise:
Zu. Chiralitätszentren
B. Formen und Gestalten von Ringen
C. Nachbarschaftseffekte zwischen Gruppen
5. Das Carbonat-Skelett . Das Hauptproblem bei den meisten organischen Synthesen ist der Aufbau des Kohlenstoffgerüsts. Der Austausch funktioneller Gruppen (IGFs) ist oft einfach durchzuführen, z. B. Keton zu Alkohol, Aldehyd zu Säure oder Alkohol zu Bromid. Die Fragen, die bezüglich des Aufbaus von CC-Links gestellt werden, lehnen sich an diejenigen an, die bereits bezüglich der Funktionsgruppe gestellt wurden.
Zu. Sind einige der verfügbaren Methoden zum Bilden funktioneller Gruppen anwendbar, um CC-Links zu erzeugen?
B. Ist die Methode mit dem spezifischen Kohlenstoffgerüst des Zielmoleküls kompatibel? Wenn es das nicht ist.
C. Gibt es ein Verfahren zur Bildung einer Kohlenstoffkette, die eine in die erforderliche umwandelbare Funktion erzeugt?
6. Vorläufermoleküle (PM)
Aus der Analyse der Struktur des Problemmoleküls und der Betrachtung der in den Schritten 1) bis 5) gestellten Fragestellungen ergeben sich zwei mögliche Arten von Vorläufermolekülen. Einer von ihnen enthält eine funktionelle Gruppe, die der der endgültigen Struktur entspricht.
Das andere ist eine Verbindung mit weniger Kohlenstoffatomen als das Zielmolekül. Wenn letztere zusammengebracht werden, werden die endgültige Kohlenstoffkette und die erforderliche Funktionalität erreicht.
Die Erzeugung irgendeines dieser Arten von Vorläufermolekülen sollte zu einer Vereinfachung des Problems führen.
Wenn ein projizierter Weg zu Vorläufern führt, die schwieriger zu synthetisieren sind als das Problem selbst (Ziel), muss im Allgemeinen ein anderer Weg gesucht werden.
Abb. 1. BAUM DER SYNTHESE
Die Erzeugung von Vorläufermolekülen, bis zu Das Erreichen der Ausgangsmaterialien erzeugt eine Reihe von Strukturen, die zusammen eine Art Baum bilden, Abb.1. Daher stammt auch der Name der Synthesemethode.
- Details
- Wilbertrivera
- ORGANISCHE SYNTHESE
- Zugriffe: 36271
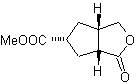
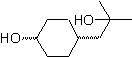
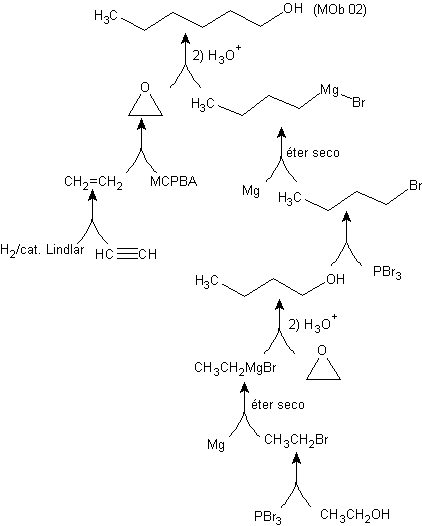
Synthese von n-Hexanol ( MOb 02)
Lösung : n-Hexanol (MOb 02) ist ein primärer Alkohol, dessen Kohlenstoffkette unverzweigt ist. Daher beschränkt sich die Strategie darauf, nach Reaktionen zu suchen, die es der Kette ermöglichen, in einer guten Anzahl von Kohlenstoffatomen zu wachsen. Es ist nicht ratsam, dass die Kette einzeln wächst, da dieser Weg zu einem Syntheseplan mit vielen Stufen und folglich zu einer geringen Ausbeute führen würde.
Als solches kann die Öffnung von Epoxidringen durch eine Grignard-Verbindung für diesen Zweck ausreichend sein; da es auch mit Acetylensynthese (Verwendung von Derivaten des Natriumacetylids und anschließende Absättigung der Dreifachbindung) kombiniert werden kann.
Das zur Kombination mit dem Grignard benötigte Epoxid wird aus einem Alken und einer Persäure hergestellt. Daraus ergibt sich der vorliegende Syntheseplan, wobei die Ausgangsstoffe Acetylen u das Äthanol.
Weiterlesen: Syntheseprobleme, gelöst durch die Synthesebaummethode
- Details
- Wilbertrivera
- ORGANISCHE SYNTHESE
- Zugriffe: 41844
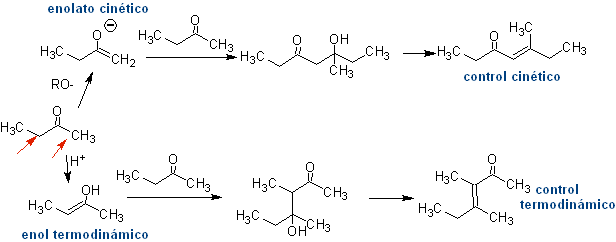
Bildung von Enolen und Enolaten
Das Alpha- Kohlenstoffatom von Verbindungen, die die Carbonylgruppe enthalten (Aldehyde, Ketone, Ester, Diketone, Diester, Nitrate, Nitrile usw.), ist das Zentrum vieler CC-Bindungsbildungsreaktionen. Aufgrund der Acidität des H a unterliegen sie in Gegenwart einer geeigneten Base einer -Deprotonierung mit nachfolgender Bildung eines Carbanions. Die resultierende negative Ladung auf C a zu C=O wird durch die gleiche Carbonylgruppe resonanzstabilisiert.
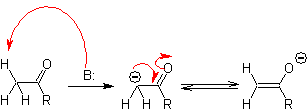
Die Auswahl der Base zur Bildung von Enolaten unterliegt der Tatsache, dass der pKa-Wert der konjugierten Säure der Base um mindestens drei Einheiten größer sein muss als der pKa-Wert der Carbonylverbindung, die saure H 's aufweist .
| pKa = 20 | MeO- pKa = 15 | Ungünstige Enolatbildung |
| pKa = 10 | tBuO- _ pKa = 19 | Sehr günstige Enolatbildung |
Bildung von Enolaten:
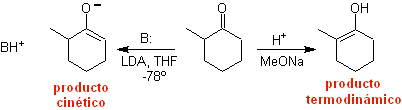
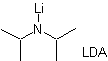
¨ Das kinetische Enolat
Es tritt auf, weil das Substrat über H α verfügt, das für die Deprotonierung durch eine typische Base wie LDA (pKa
ca 30) LDA (Lithiumdiisopropylamid) ist eine starke, nicht nukleophile, sterisch gehinderte Base. |
|
¨
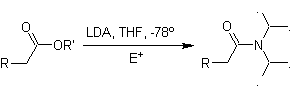
Enolate von Estern:
Ester sind anfällig für eine Substitutionsreaktion für die Base, LDA kann problematisch sein, weshalb bei Estern die nicht nukleophile Base (Lithiumisopropylcyclohexylamid) verwendet wird.
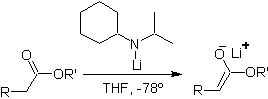
¨
Thermodynamisches Enolat:
Eine reversible Deprotonierung kann zu stabileren Enolaten führen, was auftritt, wenn das stärker substituierte C=C der Enolform erhalten wird.
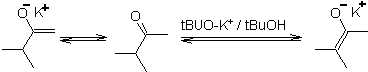
Typische Bedingungen zur Bildung thermodynamischer Enolate sind: RO-M+ in ROH als protisches Lösungsmittel (pKa von ROH = 15 bis 18).
Kinetische und thermodynamische Enolate können eingefangen, isoliert, getrennt und gereinigt werden, um regiochemisch reine Enolate zu erhalten. Dies kann durch die Bildung von Enol- und Silylenetheracetaten erreicht werden.
- Details
- Wilbertrivera
- ORGANISCHE SYNTHESE
- Zugriffe: 45803
Reaktionen von Enolen und Enolaten
Aldolreaktionen und die sogenannten Kondensationsreaktionen von Carbonylverbindungen und anderen dieser Art, die Enol- und Enolatstrukturen bilden können, nehmen an einer großen Gruppe wichtiger Reaktionen teil, die es uns ermöglichen, die Existenz einer immensen Anzahl von Molekülen zu verstehen, die aus der Wechselwirkung von Enolen oder Enolaten mit einer Reihe von elektrophilen Gruppen resultieren.
Die Untersuchung dieser Art von Reaktion hat es ermöglicht, die Existenz von zwei Reaktionsmechanismen, durch die sie auftreten, zu verifizieren und zu etablieren, wie nachstehend erläutert:
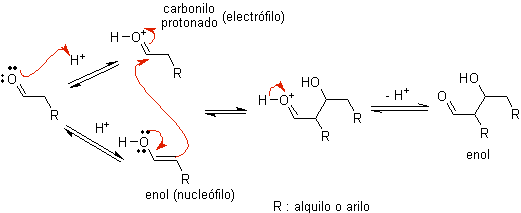
ZU)
Wenn Säure als Katalysator verwendet wird , wird die Carbonylverbindung zunächst protoniert und dann zu ihrer Enolform tautomerisiert , die ein Nucleophil am Alpha-Kohlenstoff der Carbonylgruppe ist. Das gleiche saure Medium reicht aus, um die Carbonylgruppe eines anderen Moleküls zu aktivieren, wodurch es hoch elektrophil wird, was optimale Bedingungen zur Herstellung einer ungesättigten Carbonylverbindung schafft.
Die Reaktion läuft normalerweise bis zur Dehydratisierung des gebildeten Enols ab, katalysiert durch die gleiche Säure der Reaktion.
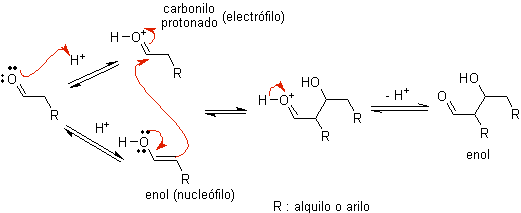
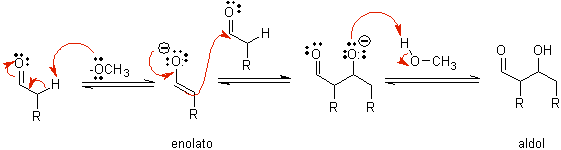
B) Wenn der Katalysator eine Base ist, wie beispielsweise ein Alkoxid, verläuft die Reaktion vom Aldoltyp über den nukleophilen Angriff des resonanzstabilisierten Enolats auf die Carbonylgruppe eines anderen Moleküls.
Durch basisch katalysierte Dehydratisierung des Aldols entsteht das dehydratisierte Endprodukt.
Wie im vorherigen Fall ermöglicht die basenkatalysierte Dehydratisierung (manchmal als Einzelschritt geschrieben) die Kontrolle der Reaktion und die Herstellung eines dehydratisierten Endprodukts. In einigen Fällen ist die Bildung von Enolaten irreversibel.
wie es aussieht in manchen Fällen ist nur eine katalytische Menge an Base erforderlich, das üblichste Verfahren ist die Verwendung einer estequiométrica Menge einer starken Base wie LDA oder NaHMDS . In diesem Fall ist die Enolatbildung irreversibel und das Aldolprodukt wird erst gebildet, wenn das Metallalkoholat des Aldolprodukts in einem späteren Schritt protoniert wird.
- Details
- Wilbertrivera
- ORGANISCHE SYNTHESE
- Zugriffe: 35363
Die organische Synthese, das Herzstück der organischen Chemie , ist im Wesentlichen eine heuristische Aktivität, das heißt, ein Prozess, bei dem die hochvoraussagenden kreativen Aktivitäten des logischen Denkens und der empirischen Verfahren, reich an künstlerischer Ausarbeitung, verschmelzen und den organischen Chemiker zu einem echten Innovator machen.
Wie jede Methode hat auch die „ Disconnection- oder Synthon-Methode “ ihre eigene Struktur, Symbologie und Sprache, die von denjenigen, die bereit sind, dieses synthetische Werkzeug zu verwenden, zunächst assimiliert und verstanden werden müssen.
Das Syntheseverfahren der Unterbrechungen oder Synthons umfasst Zwei Phasen;
![]() Phase der retrosynthetischen Analyse . Es zeigt alle Transformationen, die bei der Vereinfachung der Struktur von durchgeführt werden
Phase der retrosynthetischen Analyse . Es zeigt alle Transformationen, die bei der Vereinfachung der Struktur von durchgeführt werden
![]() Synthesephase . Wo das "Gedachte", basierend auf Kriterien der mechanistischen Rationalität und Reaktivität organischer Verbindungen, in einem Syntheseweg materialisiert, der geschrieben wird, wie er im chemischen Labor erwartet wird. Hier entsteht Erfahrung und manifestiert die „ Kunst des Tuns oder erfinden “ des Chemikers, d.h.
Synthesephase . Wo das "Gedachte", basierend auf Kriterien der mechanistischen Rationalität und Reaktivität organischer Verbindungen, in einem Syntheseweg materialisiert, der geschrieben wird, wie er im chemischen Labor erwartet wird. Hier entsteht Erfahrung und manifestiert die „ Kunst des Tuns oder erfinden “ des Chemikers, d.h.
Der Begriffe, Definitionen oder Syntheseoperationen, die in diesem Verfahren immer wieder verwendet werden, sind die folgenden:
Zielmolekül (MOb) .
Dies ist der Name für jedes Molekül, das aus einfachen und erschwinglichen Materialien synthetisiert oder hergestellt werden soll, das in einem Problem zuvor definiert oder an die Optionen angepasst werden kann, die der Chemiker in seinem Syntheseplan oder Design generiert.
Verwandlung . ( ![]() ).
).
Der spezielle unidirektionale Retrosynthesepfeil ist als symbolische Darstellung des Ausdrucks „ wird hergestellt aus “ zu verstehen und repräsentiert auch eine Art Transformation in der Struktur von
Die genannten Transformationstypen sind eigentlich retrosynthetische Operationen wie: Trennungen, Wiederverbindungen, Umlagerungen, Umwandlung funktioneller Gruppen (IGF), Addition funktioneller Gruppen (AGF), Deletion funktioneller Gruppen (SGF) usw.
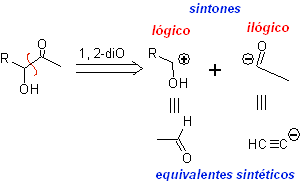
Trennung.
Es handelt sich um eine retrosynthetische Operation, die das imaginäre Aufbrechen der chemischen Bindungen darstellt, die im Zielmolekül, von den Synthonen oder genauer gesagt von ihren synthetischen Äquivalenten (Vorläufermolekülen), gebildet worden wären, postuliert.
Es kann als Umkehrung einer chemischen Reaktion verstanden werden, es wird durch einen Pfeil (sehr verschieden von dem einer chemischen Reaktion oder Gleichgewichtsbedingungen) und eine gekreuzte Wellenlinie über der Bindung dargestellt, die "getrennt" wird.
Es ist sogar möglich, die vorgeschlagene Trennung auf dem Pfeil zu platzieren: CC, CS. CX, CO, CN. usw.. Ausdrücke, die uns mit der Art der Reaktion verbinden, die verwendet wird, bei der Bildung von
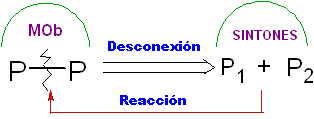
In anderen Fällen kann das verwendete Trennungsmodell geschrieben werden, zum Beispiel ist es üblich zu finden: 1, 3-diO, 1,4 –diCO, 1,5-diCO oder α, β -insatCO . Usw.
Daher können in einem dioxygenierten Molekül die folgenden Trennungen erwartet werden:
![]() heterolytische Trennungen,
heterolytische Trennungen,
![]() Homolytische oder radikale Trennungen
Homolytische oder radikale Trennungen
![]() Elektrozyklische Unterbrechungen
Elektrozyklische Unterbrechungen
![]() Verbindungsabbrüche neu ordnen
Verbindungsabbrüche neu ordnen
- Details
- Wilbertrivera
- ORGANISCHE SYNTHESE
- Zugriffe: 27320
TRENNUNG VON 1,3-DIOXYGENVERBINDUNGEN
Oxygenierte organische Verbindungen kommen in der Natur am häufigsten vor, insbesondere Dioxygenate, weshalb viele chemische Forscher die retrosynthetische Trennung dieser Moleküle modelliert haben, ein Aspekt, der in den folgenden Abschnitten untersucht wird.
Zunächst wurden die Trennungsmodelle dioxygenierter Moleküle in zwei große Gruppen eingeteilt, basierend auf der Natur der Synthone, die durch die Anwendung einer grundlegenden synthetischen Operation namens " DISCONNECTION" auf das zu synthetisierende Molekül erzeugt werden, und zwar im Allgemeinen wird als Zielmolekül (MOb) bezeichnet.
Diese großen Gruppen sind:
![]() „ Logische “ Trennungsmodelle und
„ Logische “ Trennungsmodelle und
![]() „ Anormale “ oder „ unlogische “ Trennungsmodelle
„ Anormale “ oder „ unlogische “ Trennungsmodelle
Die sogenannten "logischen" Trennungsmodelle sind solche, die durch Anwendung einer "Unterbrechung" einer oder mehrerer chemischer Bindungen in
Verbindungen, die als 1,3-Disauerstoff und 1,5-Disauerstoff klassifiziert werden können, bilden, wenn sie einer Retrosynthese unterzogen werden, im Allgemeinen Synthone, die als "logisch" gelten. Andererseits erzeugen organische Moleküle, die mit 1,2-dioxygeniertem, 1,4-dioxygeniertem und 1,6-dioxygeniertem verwandt sind, Synthone
als „unlogisch“ angesehen
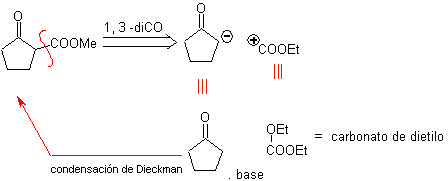
Cut-off-Modell 1,3-Disauerstoff
![]() β-Dicarbonylverbindungen
β-Dicarbonylverbindungen
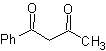
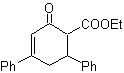
Die 1,3-Dicarbonylverbindungen werden mit guten Ausbeuten durch Kondensationsreaktionen vom Claisen-Typ erhalten, die die Reaktion zwischen Estern und Verbindungen mit aktiven Wasserstoffatomen beinhalten, wie beispielsweise: Ester, Ketone, Aldehyde, Nitrile, Nitroderivate und einige Kohlenwasserstoffe in Gegenwart von alkalische Reagenzien.
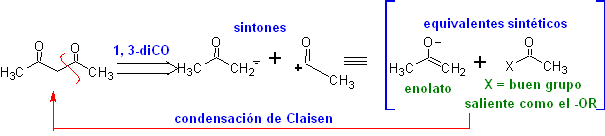
Die β-Diketone und β-Ketoaldehyde werden durch die gekreuzte Claisen-Kondensation unter Verwendung eines geeigneten Ketons und Esters erhalten. Bei der gekreuzten Claisen-Kondensation von Ketonen und Estern werden gute Ausbeuten erhalten, weil Ketone deutlich saurer sind als Ester, daher wird im basischen Medium das Keton stärker deprotoniert als der Ester.
Beispiele : Schlagen Sie ein Synthesedesign aus einfachen Materialien für die folgenden Moleküle vor:
MB 16
| Mob 17
| MB 18
|
Lösung:
MB 16 . Anscheinend sind die beiden Abschaltalternativen (a) und (b), dargestellt in
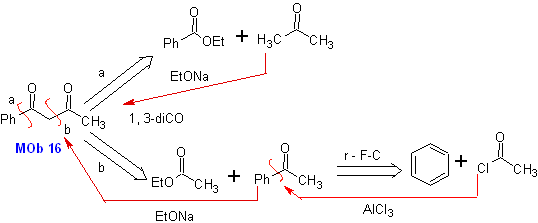
Alternative (b) erweist sich jedoch als die geeignetste, da im basischen Reaktionsmedium das gebildete Carbanion PhCOCH 2 – aufgrund von Resonanz- und Induktionseffekten besser stabilisiert würde.
- Details
- Wilbertrivera
- ORGANISCHE SYNTHESE
- Zugriffe: 25170
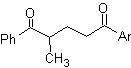
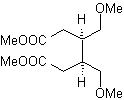
Die 1,5-dioxygenierten Verbindungen sind im Allgemeinen das Ergebnis von konjugierten Additionsreaktionen von Nucleophilen aus Carbonylverbindungen, mit saurem H α (Enole, Enolate, Enamine usw.), sowie Nitrile und Nitrate, an Substrate, die bezüglich alpha-beta ungesättigt sind zu Carbonylgruppen und dergleichen, bekannt als Michael-Reaktion, wobei komplementäre Optionen die Nef-Reaktion und die Robinson-Anellierungs-(Anellierungs-)Reaktion sind.
Trennen Modell 1, 5 Disauerstoff (1,5-diO)
Das 1,5-DiO-Entkopplungsmodell kann nach der notwendigen Funktionalisierung auf Verbindungen angewendet werden wie: 1,5-Dihydroxyle, 1,5-Hydroxyaldehyde, 1,5-Hydroxyketone, 1,5-Hydroxyester, 1,5- Ketoaldehyde, 1,5-Diketone, 1,5-Ketoester, 1,5-Dialdehyde usw.
Die Möglichkeiten steigen, wenn auch Nitroderivate und Nitrile berücksichtigt werden, die in einem basischen Medium sehr reaktive Carbanionen bilden können, die in der Lage sind, an α,β-ungesättigte Carbonylverbindungen zu addieren, um Produkte vom 1,5 -diO-Typ zu erhalten.
Die grundlegende Analyse der Trennung von 1,5-diO-Verbindungen lautet wie folgt:
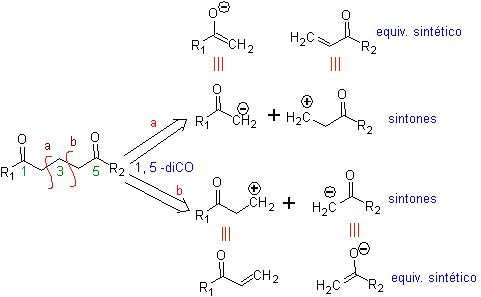
Die Wahl der Trennung (a) oder (b) um C3 hängt von der Art der R1- und R2-Gruppen ab, die dem Synthon oder synthetischen Äquivalent, das für die Bildung von notwendig ist, mehr oder weniger Stabilität verleihen können
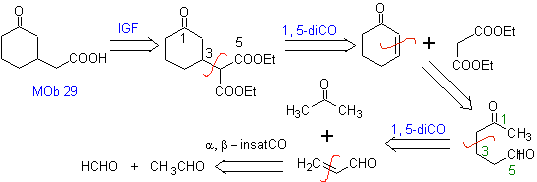
Schlagen Sie ein Synthesedesign für MOb 29, 30 und vor
MB 29
| MOB 30
| Mob 31
|
Lösung:
MB 29 . Retrosynthetische Analyse: Das zur Addition an die a , b- ungesättigte Verbindung CO benötigte Carbanion Es kann aus Diethylmalonat in basischem Medium gewonnen werden. Das wird anschließend eine Decarboxylierung erzwingen, um zu erreichen
- Details
- Wilbertrivera
- ORGANISCHE SYNTHESE
- Zugriffe: 60975
Der Schutzvorgang erfordert das folgende Verfahren:
·
Schützen Sie die reaktivsten funktionellen Gruppen selektiv und unter milden Bedingungen.
·
Führen Sie die Reaktion an der erforderlichen funktionellen Gruppe durch, ohne die geschützte Gruppe zu beeinträchtigen
·
Ungeschützte funktionelle Gruppe, geschützt
Der Schutzmaßnahmen müssen folgende Grundanforderungen erfüllen:
·
Die Reaktion muss gut ablaufen und chemoselektiv sein.
·
Die neue funktionelle Gruppe muss unter den Reaktionsbedingungen der reagierenden Gruppe stabil sein.
·
Die eingeführte Funktionalität darf dem Molekül keine Chiralitätszentren hinzufügen, die Diastereomere erzeugen können
·
Die ursprüngliche funktionelle Gruppe muss mit guter Ausbeute und ohne Beeinträchtigung des Rests des Moleküls regeneriert werden können.
Die Verwendung von Protektoren sollte auf das wesentliche Minimum reduziert werden und ihre Auswahl sollte so sein, dass sie während der gesamten Synthese nicht ersetzt werden müssen, da die Einführungs- und Entfernungsschritte (Entschützung) der Synthese Kosten und Arbeit hinzufügen und die Ausbeute verringern. Beispiel.
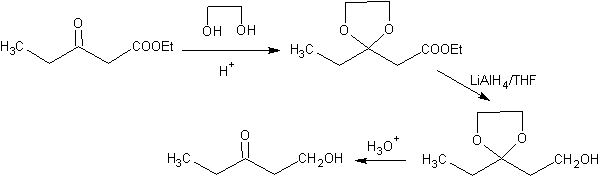
Die Ketongruppe des Moleküls wurde durch Umwandlung in ein zyklisches Ketal mit einem Ethandiol in einem leicht sauren Medium geschützt, anschließend wurde dieses Molekül mit zwei Mol Phenylmagnesiumbromid umgesetzt, das auf die Estergruppe einwirkt, um sie umzuwandeln in einen tertiären Alkohol mit zwei Methylsubstituenten, die vom Grignard beigetragen werden. Schließlich wird das zyklische Ketal hydrolysiert, um das Keton zu regenerieren.
In der Praxis gibt es keine perfekte Schutzgruppe für jede Funktionalität, stattdessen lässt sich festhalten, dass es eine große Batterie an möglichen Schutzvorrichtungen gibt, die unter Umständen die oben genannten Bedingungen erfüllen. Eine kurze Liste des Schutzes der häufigsten Gruppen ist in den folgenden Abschnitten enthalten:
SCHUTZ VOR ALDEHYDEN UND KETONEN
Eine Möglichkeit, Ketone und Aldehyde zu schützen, ist ihre Umwandlung in Acetale. Acetale können unter milden Bedingungen durch Säurehydrolysereaktionen entschützt werden.
Bei der Reduktion eines Ketoesters zu Ketoalkohol. Der Schutz des Ketons in Form eines Acetals ist sehr bequem, da das Acetal den reduzierenden Bedingungen widersteht, unter denen es bei der Umwandlung der Estergruppe in eine Hydroxylgruppe verwendet wird.
Das folgende Schema zeigt die vollständige Synthesesequenz, die es ermöglicht, die Reduktion des Esters zu erreichen, ohne das Keton zu beeinträchtigen:
In der ersten Stufe wird das Keton durch Reaktion mit Ethylenglykol in Gegenwart eines sauren Katalysators in ein cyclisches Acetal umgewandelt. In der zweiten Stufe wird der Ester mit LiAlH 4 reduziert. Dieses Reagenz greift das Acetal nicht an. Schließlich wird in der dritten Stufe das Alkoholacetal in einem wässrigen sauren Medium behandelt. Unter diesen Bedingungen wird das Acetal hydrolysiert, wodurch die ketonische Carbonylgruppe regeneriert wird. Jede der drei Stufen ist chemoselektiv, da in jeder von ihnen die bevorzugte Reaktion einer funktionellen Gruppe erreicht wird.
in Gegenwart eines anderen.
Weiterlesen: Schutz funktioneller Gruppen in der organischen Synthese
- Details
- Wilbertrivera
- ORGANISCHE SYNTHESE
- Zugriffe: 28807
Die Kontrolle in der organischen Synthese ist eine der wichtigsten Aufgaben, um die gewünschte oder geplante Umwandlung zu erreichen. und/oder zu vermeiden die Bildung solcher Nebenprodukte, die den optimalen Ablauf der betreffenden organischen Synthese wesentlich beeinträchtigen. Ebenso kann die Kontrolle allgemeiner betrachtet auch die Aspekte Symmetrie und Selektivität umfassen bzw. abdecken.
Dann sollte Kontrolle als eine Reihe von Syntheseoperationen verstanden werden, die es dem Chemiker ermöglichen, das Kohlenstoffgerüst mit der beabsichtigten Funktionalität zu bilden oder eine Gruppe oder ein Atom an der erforderlichen Stelle oder Position zu "platzieren".
Folglich können diese Operationen zu einer Vielzahl von Routinen gehören, die eine vom Chemiker widergespiegelte Absicht haben und die bestimmte kognitive Fähigkeiten und Fertigkeiten erfordern, die künstlerischen ähnlich sind, für die Konstruktion (Synthese) organischer Moleküle.
Daher können bei Kondensationsreaktionen wie bei anderen Steueroperationen in eine der folgenden Kategorien eingeschlossen werden.
![]() Konkurrenzreaktionen (Selbstkondensation und/oder Kreuzkondensation)
Konkurrenzreaktionen (Selbstkondensation und/oder Kreuzkondensation)
![]() Aktivierung – Deaktivierung
Aktivierung – Deaktivierung
![]() Selektivität und Spezifität
Selektivität und Spezifität
![]() Schutz-Entschützung
Schutz-Entschützung
Bei den Kondensationsreaktionen von Carbonylverbindungen ist es wichtig, die Reihenfolge der Ereignisse im Voraus festzulegen, um die Möglichkeiten der Selbstkondensation und das Auftreten von Kreuzkondensation, die leider eine offensichtliche Bedrohung bei diesen Reaktionen darstellen, zu minimieren oder gegebenenfalls zu unterdrücken .
Selbstkondensation
Alle Carbonylverbindungen mit einem oder mehreren alpha-Wasserstoffen an den Kohlenstoffen neben der Carbonylgruppe laufen Gefahr, eine Selbstkondensationsreaktion zu erleiden, wenn die entsprechende Strenge nicht befolgt wird.
Wenn also beispielsweise eine nicht-hydroxylierte Base wie EtONa zu einem 2-Butanon hinzugefügt wird, wird ein Enolat gebildet, das sich schließlich mit einem anderen Molekül desselben Ketons verbinden könnte. Ebenso kann es bei Zugabe von H+ auch zur Selbstkondensation kommen, wie aus dem folgenden Schema ersichtlich: Dies kann minimiert werden, indem die Base oder Säure zu der Verbindung, die das Enol oder Enolat liefert, und der Carbonylverbindung, die am Carbonylkohlenstoff angegriffen wird, mit der gleichen Geschwindigkeit aus getrennten Zuführungen zugegeben wird . Ein Dreihalskolben und Magnetrührer können verwendet werden.
Kreuzkondensation
Idealerweise sollte bei Kondensationsreaktionen von Carbonylverbindungen eines der reagierenden Moleküle schnell enolisieren, während das andere vorzugsweise kein Hα aufweisen sollte. , um sicherzustellen, dass keine anderen Nebenprodukte gebildet werden
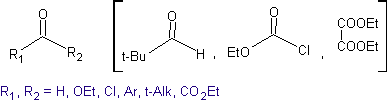
Die nachstehend analysierte Retrosynthese ist ein gutes Beispiel für das, was zuvor angedeutet wurde.
Weiterlesen: Kontrolle der Kondensation von Carbonylverbindungen
- Details
- Wilbertrivera
- ORGANISCHE SYNTHESE
- Zugriffe: 25694
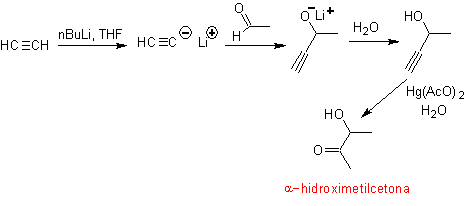
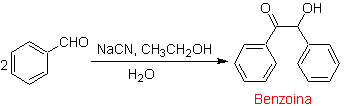
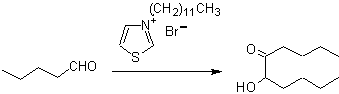
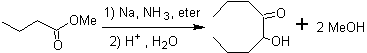

- Details
- Wilbertrivera
- ORGANISCHE SYNTHESE
- Zugriffe: 26226
TRENNEN VON 1,4-DIOXYGENVERBINDUNGEN
Eine weitere Gruppe von Verbindungen von großer Bedeutung für die chemische Synthese sind dioxygenierte Moleküle, die in einem Abstandsverhältnis von 1,4 vorkommen. Diese Verbindungen erzeugen, wenn sie einer retrosynthetischen Trennungsanalyse unterzogen werden, Synthone, bei denen eines von ihnen, das Elektrophil oder das Nucleophil, als "anomal" oder "unlogisch" angesehen werden kann, da die einem der Atome zugeordnete Ladung nicht erklärt werden kann hinsichtlich seiner intrinsischen oder induzierten Elektronegativität.
1. 1,4-Disauerstoffverbindungen (1,4-diO)
Bei dieser Art von Verbindungen führt die Trennung auch zu einem logischen Synthon und zu einem anderen unlogischen (nicht natürlichen) Synthon, das ein Nucleophil oder ein Elektrophil sein kann, dessen synthetisches Äquivalent noch angemessen überarbeitet werden muss, um verwendet zu werden die reaktion chemie.
1. 1. Verbindungen 1,4-Dicarbonyl
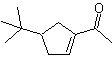
1.1.1. 1,4-Diketonverbindungen
Die Trennungsalternativen dieser Art von zu synthetisierenden Verbindungen oder Molekülen (MOb) können zu folgenden Optionen führen:
Zu. Ein logisches Anionensynthon und ein unlogisches Kationensynthon
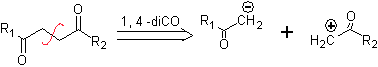
Das synthetische Äquivalent des Anions ist das Enolat-Ion oder das Enol selbst der Carbonylverbindung. Stattdessen ist das synthetische Äquivalent für das Carbokation Alpha-Halocarbonyl. (Umpolung)
B. Ein logisches Kationensynthon und ein unlogisches Anionensynthon
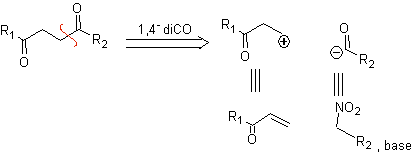
Das synthetische Äquivalent des logischen Kationensynthons ist die α,β-ungesättigte Carbonylverbindung. Ein geeignetes synthetisches Äquivalent für das Anionen-Synthon kann ein Nitroalkan-Anion sein. Die -NO 2 -Gruppe in Alkanen kann durch die Nef-Reaktion oder durch die Variante der McMurry-Reaktion, bei der durch Einwirkung von TiCl 3 das Nitroalkan in ein Imin umgewandelt wird, das dann It ist, in C=O umgewandelt werden in saurem Medium zur jeweiligen Carbonylverbindung hydrolysiert wird.
1.1.2.
1,4-Ketoester-Verbindungen
γ-Ketoester, 1,4-Diester und 1,4-Disäuren können an ein natürliches Kationensynthon, dessen synthetisches Äquivalent eine α,β-ungesättigte Carbonylverbindung ist, und an das nicht-natürliche („unlogische“) ) Anionensynthon (-) COOR, dessen synthetisches Äquivalent das Cyanidion ist.
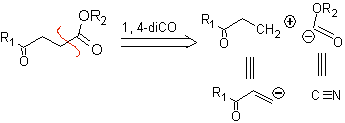
Beispiele: Schlagen Sie ein Synthesedesign aus einfachen und erschwinglichen Materialien für jedes der folgenden Moleküle vor:
MB 35
| MB 36
| |
MB 37
| MB 38
|
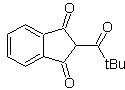
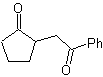
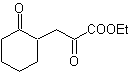
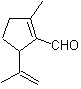
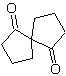
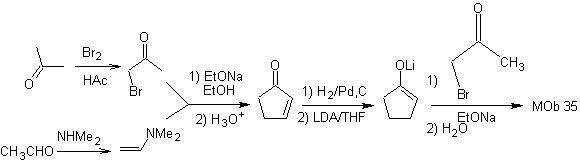
MOb 35 (a). Retrosynthetische Analyse . Das Molekül kann nach dem 1,4-diCO-Modell getrennt werden. Das erzeugte Vorläufer-Cyclopentanon muss zuvor aktiviert werden, damit sein Cα nukleophiler wird, und dann in der Reaktion mit α.Bromaceton verwendet werden.
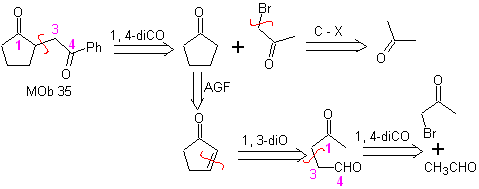 Synthese . Die Nucleophilie von Cyclopentanon wird kontrolliert und garantiert, indem LDA verwendet wird, um zu erreichen
Synthese . Die Nucleophilie von Cyclopentanon wird kontrolliert und garantiert, indem LDA verwendet wird, um zu erreichen
- Details
- Wilbertrivera
- ORGANISCHE SYNTHESE
- Zugriffe: 21713
Die 1,6-difunktionalisierten Verbindungen verwenden vorzugsweise die Wiederverbindungsstrategie für ihre jeweilige Synthese; Diese Strategie kann sehr gut mit der Diels-Alder-Reaktion, die im Allgemeinen sechsgliedrige olefinische Addukte liefert, oder der Birch-Reduktion von Benzolringen, die ebenfalls sechsgliedrige olefinische Produkte erzeugt, kombiniert werden.
1.
1,6-dioxygenierte Verbindungen
Die Reaktion, die Dicarbonylverbindungen verschiedener möglicher Kombinationen erzeugt: Diketone, Ketosäuren, Ketoaldehyde, Disäuren usw. und in unterschiedlichen Abständen voneinander, ist zweifellos die Reaktion von Ozonolyse olefinischer Verbindungen.
Je nach Struktur des Substrats und den Reaktionsbedingungen am gebildeten Ozonid-Zwischenprodukt wird durch die Spaltung der olefinischen Doppelbindung eine enorme Verbindungsvielfalt erreicht. Von besonderem Interesse sind dabei diejenigen, die in einem 1,6-dioxygenierten Verhältnis vorliegen, wie aus der folgenden synthetischen „Wiederverbindungs“-Operation gefolgert werden kann:
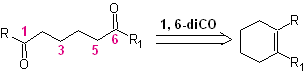
Der beste Weg, um die Funktionsweise dieser "synthetischen Wiederverbindungsoperation" zu verstehen, ist
wird durch die Lösung der Synthese der folgenden organischen Moleküle erreicht:
MB 50
| MB 51
| MB 52
| ||
MB 53
| MB 54
| MB 55
|
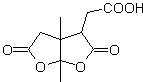
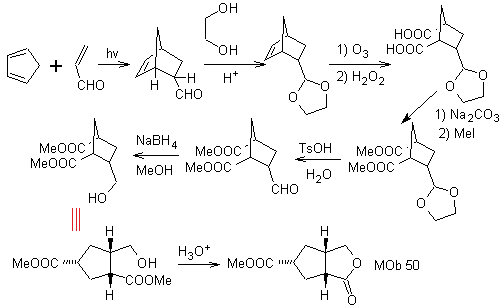
MB 50 . Retrosynthetische Analyse : In erster Linie wird es durch die Lactonfunktion des Moleküls getrennt. An dem erzeugten Vorläufermolekül wiederum kann argumentiert werden , dass seine Bildung möglicherweise aus der Diacarbonsäure in Position 1-6 erfolgt ist. Die wieder verbunden werden, um das Alken zu ergeben, das sie durch oxidative Ozonolysereaktion erzeugt hat. Das gebildete Alken ist ein typisches Diels-Alder-Addukt zwischen Cyclopentadien und Crotonaldehyd.
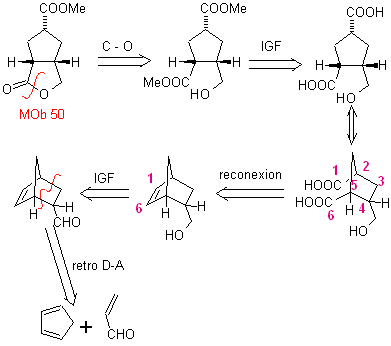
Synthese: Die Diels-Alder-Reaktion zwischen Cyclopentadien und der α,β-ungesättigte Aldehyd stellt das Alken-Addukt für seine entsprechende Öffnung durch oxidative Ozonolyse vor einer Schutzreaktion der Aldehydgruppe bereit, die anschließend entschützt wird, um zur Alkoholfunktion reduziert zu werden. Dieser Alkohol reagiert mit der Estergruppe in einem sauren Medium, um das gewünschte Lacton, MOb 50, zu bilden
- Details
- Wilbertrivera
- ORGANISCHE SYNTHESE
- Zugriffe: 25105
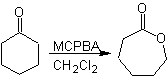
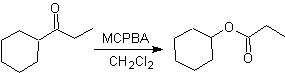
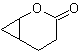
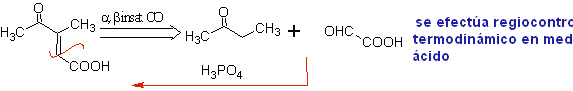
Baeyer-Villiger-Oxidation
Eine weitere Reaktion, die mit der Strategie der verbunden werden kann Retrosynthese ist die Oxidation von Ketonen durch Peroxysäuren, besser bekannt als Baeyer-Villiger-Reaktion. In zyklischen Ketonen erzeugt die Oxidation mit Persäuren Lactone. Die an die asymmetrischen Ketone gebundenen Gruppen haben eine Migrationsfähigkeit, die es buchstäblich ermöglicht, "ein Sauerstoffatom zwischen die Carbonylgruppe und die wandernde Gruppe einzufügen", wodurch ein Ester oder ein Lacton erzeugt wird.
Dabei ist zu berücksichtigen, dass Enone (α,β-ungesättigte Ketone) keine guten Substrate für die Baeyer-Villiger-Oxidation sind, da das Alken viel reaktiver ist als das Keton. Jedoch Es gibt spezielle Strukturen, bei denen das Alken aufgrund des sterischen Effekts durch einen nahegelegenen Substituenten geschützt werden kann und so den Angriff der Persäure auf die Carbonylgruppe lenkt.
| … |
|
Denken Sie daran, dass die Migrationsfähigkeit der verschiedenen Gruppen in der Baeyer-Villiger-Reaktion wie folgt ist:
H> Ph> 3º Alkyl> Cycloalkyl> 2º Alkyl> 1º Alkyl> Me
Schlagen Sie einen Syntheseplan für die folgenden Moleküle vor:
MB 56
L-Dopa | . | MB 57
| . | MB 58
|
MB 59
| MB 60
| Mob 61
|
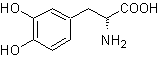
MB 56. Retrosynthetische Analyse.
Die Alpha-Aminosäure
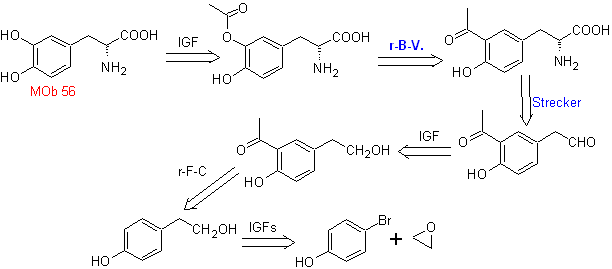
Synthese. Für Für die Bildung des benötigten Grignards wird das ortho-OH des Benzols geschützt. Die Strecker-Synthese ermöglicht die Bildung der alpha-Aminosäure, die nach Baeyer-Villiger mit einer Persäure oxidiert wird und das Produkt einer sauren Hydrolyse der Estergruppe unterliegt, die zur Bildung von führt
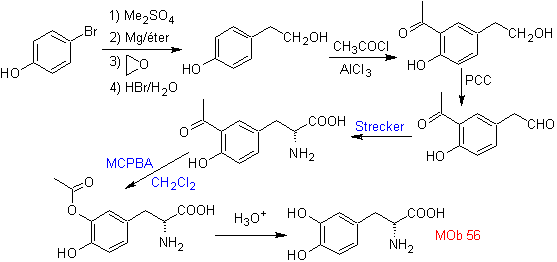
Weiterlesen: Baeyer-Villiger-Oxidation als Strategie in der Retrosynthese
- Details
- Wilbertrivera
- ORGANISCHE SYNTHESE
- Zugriffe: 28982
Die Beckmann-Transposition als Strategie in
Die als Beckman-Umlagerung bezeichnete Umlagerung von Oximen in einem sauren Medium erzeugt ein Amid oder Lactam, wenn das Ausgangsketon linear bzw. zyklisch ist.
Um die Leistung dieses Reaktionstyps zu verbessern, wurden verschiedene Katalysatoren und saure Medien untersucht. So sind beispielsweise neue saure Medien, die als Katalysatoren mit dem angegebenen Zweck verwendet werden: TCT/DMF, DAST/CH 2 Cl 2 , CF 3 SO 3 H, PCl 5 , HgCl 2 /MeCN und das ZnO.
TKT: Trichlortriazin | …… | DAST: Diethylaminosulfidtrifluorid |
Die Migrationsfähigkeit der Gruppen ist dieselbe wie bei der Baeyer-Villiger-Reaktion. Schlagen Sie ein Synthesedesign für jedes der folgenden Moleküle vor:
MB 62 | Mob 63 | MB 64 |
MB 62 . Retrosynthetische Analyse.
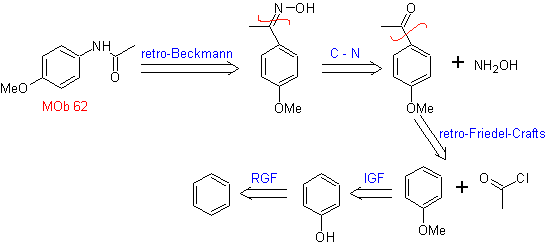
Synthese. Die Reaktion des intermediären aromatischen Ketons mit NH 2 OH und seine anschließende Behandlung mit einer wässrigen Lösung aus Schwefelsäure und ZnO ermöglicht die Bildung des aromatisches Amid MOb 62.
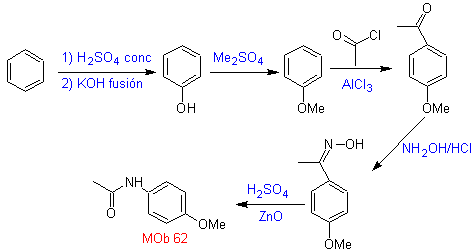
Weiterlesen: Beckmann-Umlagerung als Strategie in der Retrosynthese
- Details
- Wilbertrivera
- ORGANISCHE SYNTHESE
- Zugriffe: 20959
Andere Synthesestrategien, die „unlogische“ Syntons verwenden
1.
Dreifachbindungsaddition
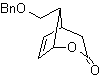
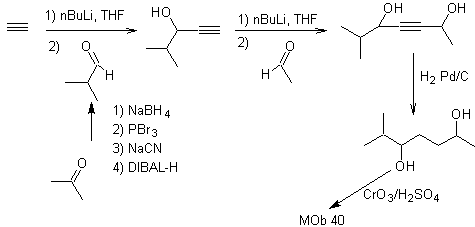
Die Strategie des "Hinzufügens" einer Dreifachbindung zwischen zwei sauerstoffhaltigen Funktionen in Position 1,4 ermöglicht es, später mit einer Trennung zu arbeiten, die auf der Chemie von Acetyliden basiert. Um diese Strategie zu veranschaulichen, sehen wir uns die Ausarbeitung eines Syntheseplans für an
Mob. 40. Retrosynthetische Analyse . Ein erstes IGF in
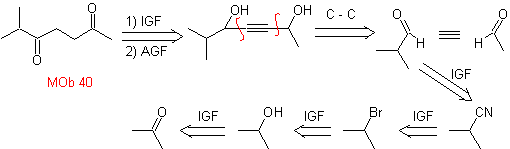
Synthese. Das Diacetylid oder Acetylid verbindet sich stufenweise mit Molekülen aus verschiedenen Aldehyden wird das gebildete Zwischenmolekül hydriert und anschließend werden seine Alkohole zur diketonischen Verbindung Mob 40 oxidiert.
Die γ-Lactone können auch auf analoge Weise hergestellt werden, wie unten gezeigt:

2.
Hinzufügen der COOR-Gruppe als aktivierende Gruppe
Die Addition der COOR-Gruppe erleichtert zusätzlich zur Aktivierung des Anionensynthons die Trennung eines 1,4-diX-Moleküls.
synthetisieren |
|
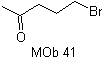
MOb 41. Retrosynthetische Analyse.
Weiterlesen: Andere Synthesestrategien, die "unlogische" Syntons verwenden
- Details
- Wilbertrivera
- ORGANISCHE SYNTHESE
- Zugriffe: 50557
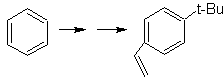
SYNTHESE VON AROMATISCHEN VERBINDUNGEN I
(Synthesebaum-Methode)
Schlagen Sie einen Syntheseplan mit Toluol oder Xylol als Ausgangsmaterialien für die folgenden Moleküle vor:
(MOb 12)
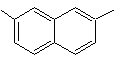
1-Isopropyl-7-methylnaphthalin | (MOb 13)
2,7-Dimethylnaphthalin |
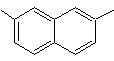
(MOb 14)
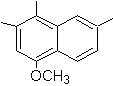
1-Isopropyl-6-methylnaphthalin | (MOb 15)
4-Methoxy-1,2,7-trimethylnaphthalin |
Lösung: (MOb 12).
Bei der angenommenen Strategie wird berücksichtigt, dass die letzte Stufe auf einen "Aromatisierungsprozess" reagieren kann, für den vorgeschlagen wird, dass das Vorläufermolekül einen nichtaromatischen Ring mit einer Doppelbindung darstellt.
an dem Kohlenstoff, der die Doppelbindung und die Alkylgruppe enthält.
Diese Struktur kann durch die Einwirkung eines Grignards auf ein Carbonyl und die anschließende Dehydratisierung des gebildeten Alkohols erreicht werden. Das Keton wird durch Acylierung an der entsprechenden Benzolverbindung mit Bernsteinsäureanhydrid und seinen anschließenden intramolekularen Acylierungsabschlüssen nach Friedel-Crafts gebildet.
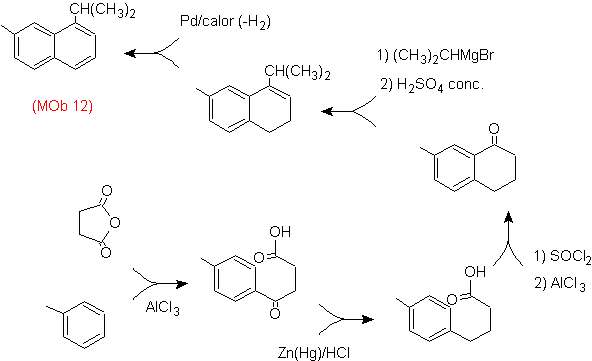
Lösung (MOb 13).
Auch hier muss das Vorläufermolekül "aromatisiert" werden, unter anderem die geeignetste Strategie Es basiert auf der Kombination von Acylierung mit substituiertem Bernsteinsäureanhydrid und der Clemmensen-Reduktion.
Das endgültige Carbonyl wird zu Alkohol reduziert, der dann mit molekularem Wasserstoff und einem Katalysator namens Kupferchromyl dehydriert wird.
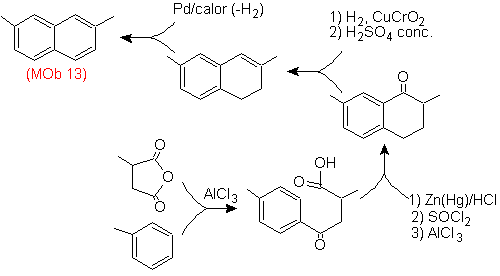
- Details
- Wilbertrivera
- ORGANISCHE SYNTHESE
- Zugriffe: 29395
SYNTHESE VON AROMATISCHEN VERBINDUNGEN II
(Synthesebaum-Methode)
Obwohl eines der ersten zu lösenden Probleme bei der Synthese mehrfach substituierter Aromaten die Kontrolle der Orientierungseffekte und die Bildung unerwünschter Isomere ist, ist es auch wichtig, die Reaktivität der Arene zu untersuchen, da irgendwann in der In Anbetracht des Vorhandenseins aliphatischer Gruppen in der aromatischen Verbindung weisen sie häufig Eigenschaften und Reaktivitäten auf, die typisch für die Art der organischen Verbindung sind, zu der sie gehören, und die besonderen, die sich aus der gegenseitigen Wechselwirkung der aliphatischen und aromatischen Gruppen ergeben.
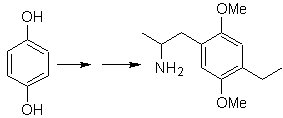
Auf diesem Zweck basiert es, die Synthese der Moleküle Nr. 20 bis 27, Diesmal aus bestimmten Materialien, daher stellt sich die Frage wie folgt: Welche Reaktionen gibt es? Begründen Sie die folgenden Umformungen?
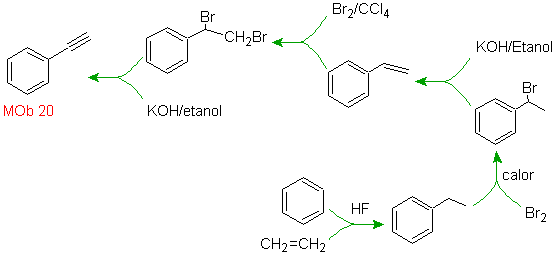
Mob20-Lösung.
Wir wissen, dass es daher keine Möglichkeit gibt, dass das Acetylidion direkt auf Benzol einwirkt die Dreifachbindung wird von einer Alkylgruppe erhalten
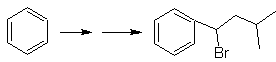
vec-dibromiert, das durch Bromierung von Styrol erhalten wird, das zuvor durch Dehydrobromierung erhalten wurde eines Benzylhalogenids, das durch eine Bromierung nach dem Radikalmechanismus an Ethylbenzol gebildet wird
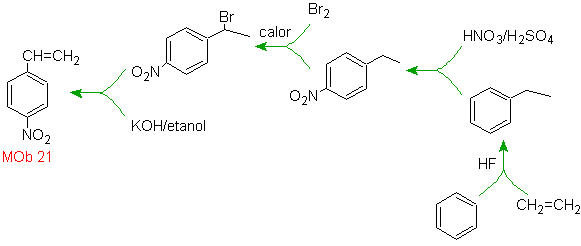
Lösung Mob 21.
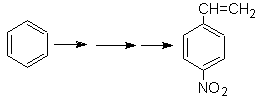
Das para-Nitrostyrol kann nicht durch direkte Nitrierung von Styrol erhalten werden, da die an den Ring gebundene Ethenylgruppe unter Nitrierungsbedingungen instabil ist.
Als solches wird das Vorläufermolekül eine Gruppe aufweisen, die leicht zu dehydrobromieren ist. Diese Vorstufe wird durch radikalische Bromierung der an den Benzolring gebundenen Ethylgruppe erhalten, die zuvor hauptsächlich in para-Stellung nitriert wurde.
- Details
- Wilbertrivera
- ORGANISCHE SYNTHESE
- Zugriffe: 32207
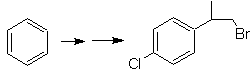
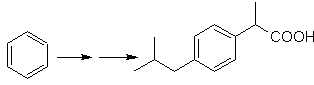
SYNTHESE VON ALKOHOLE
(Synthesebaum-Methode)
Schlagen Sie einen Syntheseplan für die angegebenen Zielmoleküle aus den angegebenen Einzelmolekülen (MOb 30 -41) vor. Verwenden Sie dazu die Reagenzien und Reaktionsbedingungen, die Sie für notwendig halten:
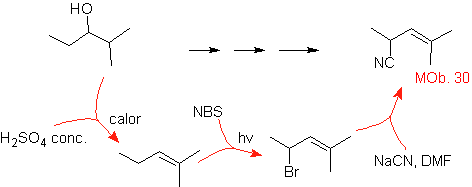
MOb 30-Lösung.
Strategie: Es wird beobachtet, dass das Ausgangsmolekül dehydratisiert wurde und in der anfänglich unsubstituierten allylischen Position ein Wasserstoff durch die Cyano- oder Nitrilgruppe ersetzt wurde. Diese letzte Reaktion kann nur stattfinden, wenn das Vorläufermolekül ein Allylhalogenid ist, weshalb es als Vorläufer von vorgeschlagen wird
Das Br wird an der gewünschten Position mit dem NBS eingeführt und das Alken ist das Produkt der Dehydratisierung des Ausgangsmoleküls.
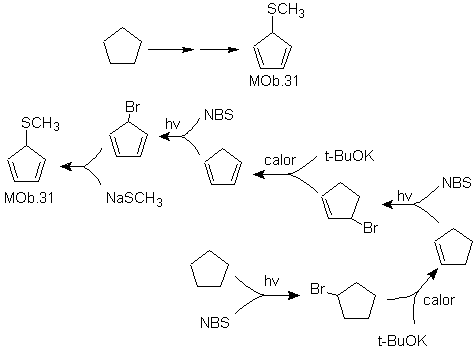
Lösung MOb 31.
Strategie : Es ist ein Onkelether, das notwendige Vorläufermolekül wird ein 1,3-Cyclopentadienhalogenid sein.
Dieses Halogenid wird durch die Einwirkung von NBS auf das dienische Cycloalken hergestellt, das wiederum durch die Dehydrobromierung des Vorläufermoleküls hergestellt wird, die durch die Einwirkung von NBS auf das gebildete Cycloalken erreicht wird. zuvor durch Dehydrohalogenierung des radikalisch bromierten Ausgangsmoleküls
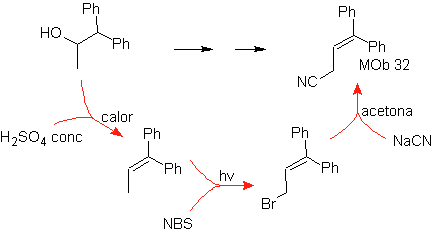
Mob 32-Lösung.
Strategie : Es ist ähnlich wie beim Erhalten
- Details
- Wilbertrivera
- ORGANISCHE SYNTHESE
- Zugriffe: 24791
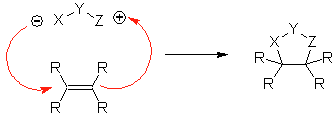
Diese Reaktionen bilden normalerweise fünfgliedrige heterocyclische Ringe, für die die Reaktion zwischen einer dipolaren n1,3-Verbindung und einem Alken notwendig ist. Die Reaktion ist eine [3-2]-Cycloaddition. Die 1,3-dipolaren Verbindungen, die am häufigsten zur Bildung von pentagonalen Heterocyclen verwendet wurden, sind:
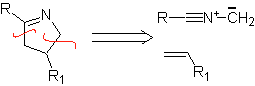 | 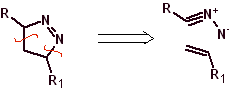 |
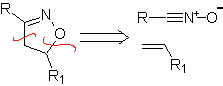 | 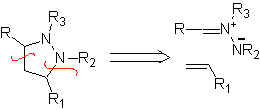 |
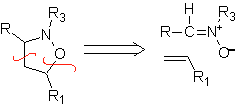 | 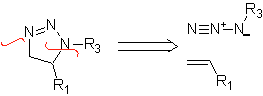 |
| MB: 86
| . | MB: 87 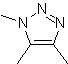 | .. | MB: 88 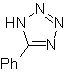 |
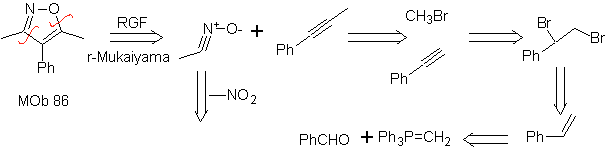
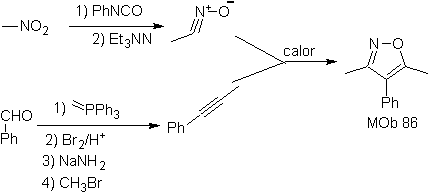
Weiterlesen: Synthese von Heterocyclen durch intermolekulare Cyclisierung