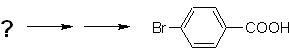SINTESI DI COMPOSTI AROMATICI I
(Metodo dell'albero di sintesi)
Proporre un piano di sintesi, utilizzando toluene o xilene come materiali di partenza, per le seguenti molecole:
(MOb 12)
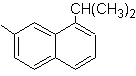
1-isopropil-7-metilnaftalene | (MOb 13)
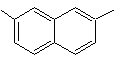
2,7-dimetilnaftalene |
(MOb 14)
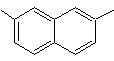
1-isopropil-6-metilnaftalene | (MOb 15)
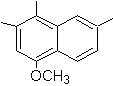
4-metossi-1,2,7-trimetilnaftalene |
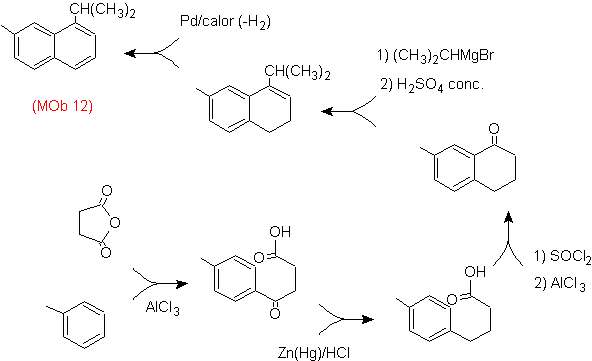
Soluzione: (MOb 12).
Nella strategia che si assume si tiene conto che l'ultimo stadio può rispondere ad un processo di "aromatizzazione", per il quale si propone che la molecola precursore presenti un anello non aromatico, con un doppio legame.
sul carbonio contenente il doppio legame e il gruppo alchilico.
Questa struttura può essere ottenuta mediante l'azione di un Grignard su un carbonile e la successiva disidratazione dell'alcool formatosi. Il chetone è formato dall'acilazione sul composto benzenico appropriato con anidride succinica e le sue successive chiusure di acilazione intramolecolare di Friedel-Crafts.
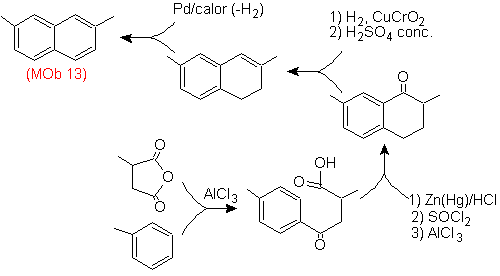
Soluzione (MOb 13).
Ancora una volta, la molecola precursore deve essere "aromatizzata", la strategia più appropriata tra le altre Si basa sulla combinazione di acilazione con anidride succinica sostituita e riduzione di Clemmensen.
Il carbonile finale viene ridotto ad alcol che verrà poi disidratato con idrogeno molecolare e un catalizzatore chiamato rame cromilico.
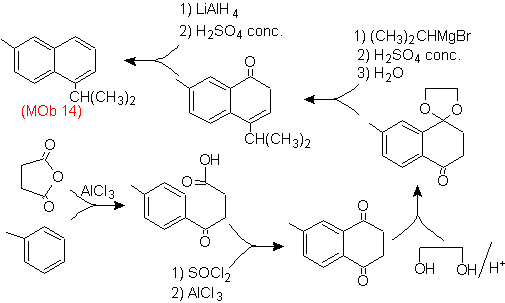
Soluzione (MOb 14).
L'aromatizzazione finale si ottiene dopo aver ridotto un gruppo carbonilico ad alcol e quindi averlo disidratato. La molecola precursore si ottiene per acilazione con anidride succinica.
Il carbonile che deve essere attaccato da un Grignard per introdurre il gruppo alchilico e generare l'alcool che verrà disidratato, è temporaneamente protetto come acetale ciclico.
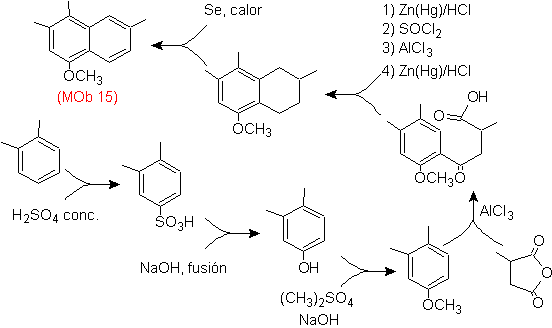
Soluzione Mob 15 .
Si ritiene che l'anello più sostituito corrisponda all'anello aromatico che per acilazione adatto con un derivato dell'anidride succinica, permetterà la chiusura di un anello, con un'intelligente combinazione di acilazione e riduzione del carbonile.
L'anello benzenico con la funzionalità richiesta viene preparato da o-xilene, che viene solfonato e il gruppo –OH viene protetto eterificandolo fino in fondo.
L'acilazione del naftalene è soggetta ad un interessante effetto solvente. La reazione in disolfuro di carbonio o solventi alogenati produce un attacco prevalentemente in posizione a , tuttavia, in soluzione di nitrobenzene, la dimensione dell'aggressore elettrofilo aumenta per solvatazione con nitrobenzene, attaccando la posizione b , che è meno ostacolata stericamente.
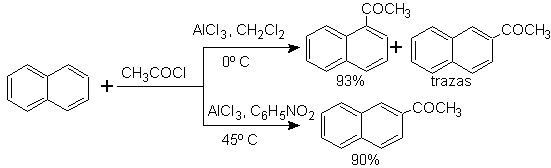
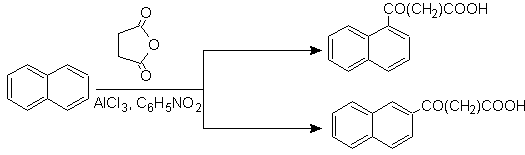
La succinoilazione del naftalene a nitrobenzene produce una miscela separabile di isomeri aeb , entrambi utilizzati nella sintesi dei derivati del fenantrene.
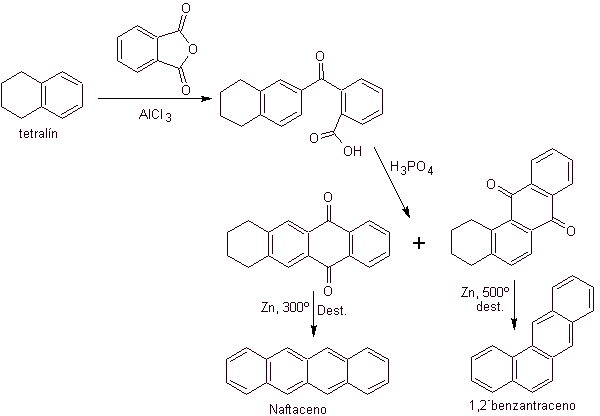
La tetralina è acilata esclusivamente in posizione b , dimostrando la resistenza dei derivati 2-ftaloilici alla ciclizzazione in posizione 3 per dare condensati lineari.
Esempio: sintetizzare l'acido p -bromobenzoico dal benzene e i reagenti necessari. |
MOb 16 |
Soluzione (MOb 16).
È necessario chiedere "Cos'è un precursore immediato dell'acido p-bromobenzoico?" L'analisi retrosintetica di
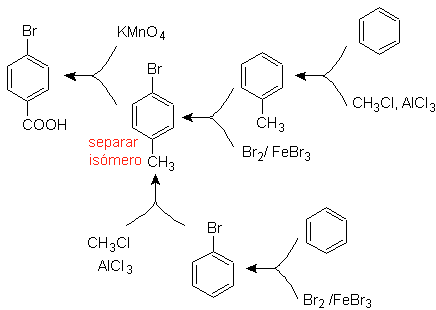
L'opzione migliore è quella che utilizza il toluene come intermedio, poiché il gruppo metilico attiva debolmente l'anello benzenico e migliora la resa di formazione del p-bromotoluene.
Nella seconda via di sintesi si tenga conto che il bromo è un anello disattivante, e quindi la resa della reazione sarà ovviamente molto inferiore rispetto alla prima via. Tuttavia, si deve capire che non c'è un solo prodotto nella sintesi, poiché si formerà anche l'isomero orto-sostituito, che deve necessariamente essere separato nel processo di sintesi.
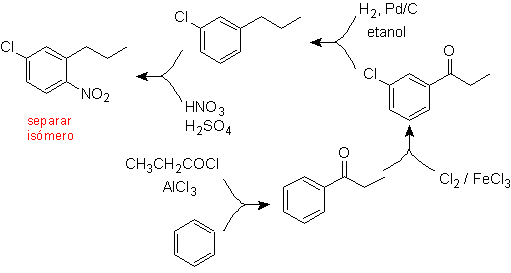
Un secondo caso, che mostra le caratteristiche di una multi-sostituzione elettrofila dell'anello benzenico, è la sintesi del 4-cloro-1-nitro-2-propilbenzene (MOb. 17) da benzene.
Soluzione (MOb 17).
In linea di principio ci sono tre possibili precursori di-sostituiti, ma solo uno di essi è adatto. Anche in questo caso vi è un'elevata probabilità di formazione dell'isomero 2-cloro-1-nitro-4-propilbenzene.
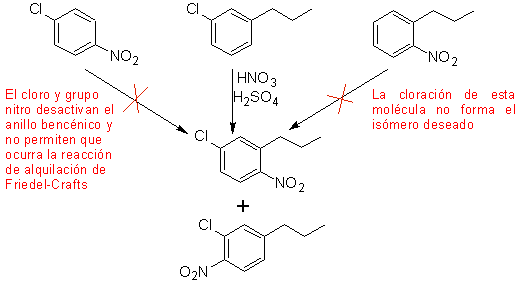
l'ultima sintesi di
È ormai chiaro che uno dei compiti del chimico è progettare percorsi di sintesi che portino il più possibile alla formazione di un unico prodotto con le rese più elevate, evitando cioè la formazione di isomeri durante l'intero processo. Per esemplificare questo aspetto studieremo la sintesi delle seguenti molecole:
Assalire. 18
| Assalire. 19
|
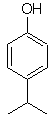
Soluzione MOb 18
Il bromo è orientato orto e disattiva anche l'anello benzenico, quindi la strategia ricorre a posizionare un gruppo fortemente attivante nelle posizioni orto e para di un nuovo elettrofilo e dopo aver generato la reazione, rimuovere il gruppo attivante dall'anello benzenico.
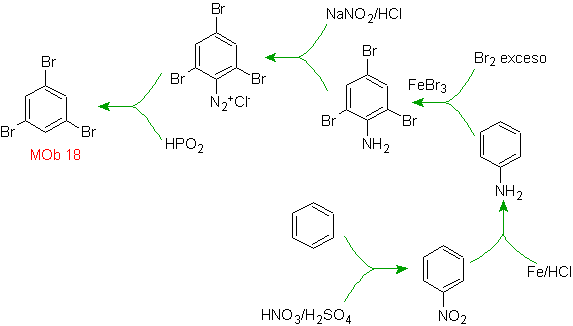
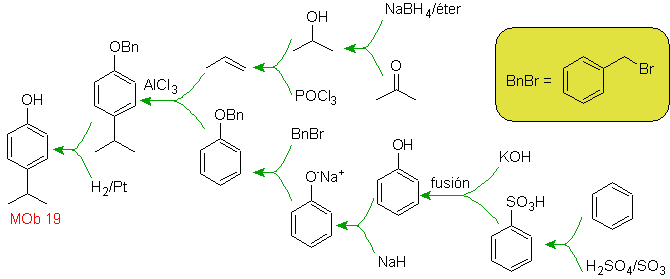
Il gruppo –OH è un forte attivatore dell'anello benzenico e un orientamento orto-para. Di conseguenza, possiamo trasformare il gruppo –OH in un gruppo molto più grande, cioè voluminoso, che eserciterà un ingombro sterico per qualsiasi elettrofilo che si avvicini all'anello e lo orienterà solo verso la posizione para. Infine, verrà ripristinato il gruppo –OH, per raggiungere la molecola bersaglio.