REAZIONI IN CHIMICA ORGANICA
- Dettagli
- Germán Fernández
- REAZIONI IN CHIMICA ORGANICA
- Visite: 12699
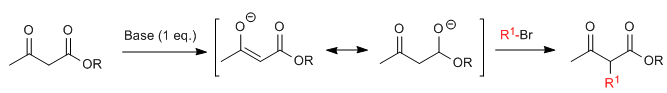
La sintesi acetilacetica consente di preparare chetoni mediante alchilazione C dell'etil acetilacetato (etil 3-ossobutanoato). L'etil acetoacetato può essere deprotonato in posizione C2 o C4 a seconda del tipo e della quantità di base utilizzata. Gli idrogeni in posizione C2 presentano acidità significativa (pKa=11) dovuta alla stabilizzazione della base coniugata sui due carbonili vicini.
- Dettagli
- Germán Fernández
- REAZIONI IN CHIMICA ORGANICA
- Visite: 25370
La condensazione aciloinica trasforma gli esteri in alfa-idrossichetoni. Questa reazione viene condotta con sodio metallico in un solvente inerte. 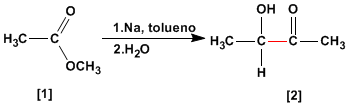
- Dettagli
- Germán Fernández
- REAZIONI IN CHIMICA ORGANICA
- Visite: 28788
La condensazione aldolica è una reazione di aldeidi o chetoni. che forma 3-idrossicarbonili (aldoli) . 3-idrossialdeide in condizioni di disidratazione per riscaldamento si ottiene un'aldeide alfa, beta-insatura . 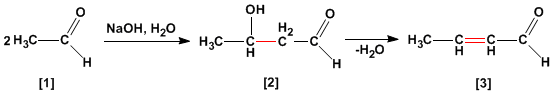
- Dettagli
- Germán Fernández
- REAZIONI IN CHIMICA ORGANICA
- Visite: 13729
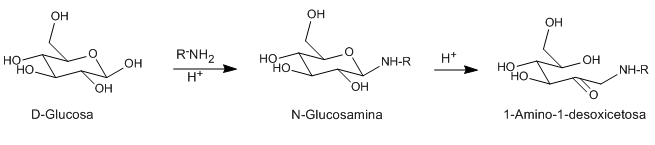
Acidi e basi catalizzano l'isomerizzazione di N-glicosidi (glicosammine) da aldosi a 1-amminodeossichetosi. Questo riarrangiamento può essere catalizzato con un certo numero di acidi di Lewis (CuCl 2 , MgCl 2 , AlCl 3 , SnCl 4 ). L'ammina utilizzata come reagente può essere primaria o secondaria, alifatica o aromatica.
- Dettagli
- Germán Fernández
- REAZIONI IN CHIMICA ORGANICA
- Visite: 23039
La reazione di Abuzov viene utilizzata nella sintesi dei fosfonati dai fosfiti . I fosfonati ottenuti nella sintesi di Abuzov sono usati come materiali di partenza nella sintesi di Horner-Wittig. 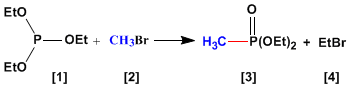
- Dettagli
- Germán Fernández
- REAZIONI IN CHIMICA ORGANICA
- Visite: 27950
Cloruro di acetile [1] è trattato con diazometano [2] ottenendo il sale di diazonio [3]. cloruro prodotto reagisce con il sale di diazonio per dare l'α-clorochetone . 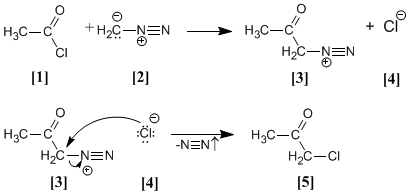
- Dettagli
- Germán Fernández
- REAZIONI IN CHIMICA ORGANICA
- Visite: 10256
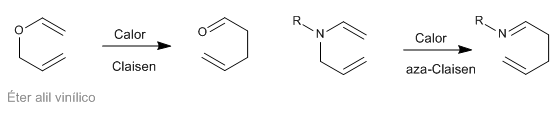
I riarrangiamenti sigmatropici [3,3] delle N-allilenammine sono noti come riarrangiamenti aza-Claisen. Questa reazione è analoga al riarrangiamento di Claisen degli allil vinil eteri.
- Dettagli
- Germán Fernández
- REAZIONI IN CHIMICA ORGANICA
- Visite: 10467
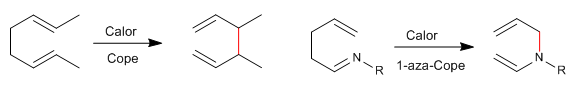
Gli 1,5-dieni si isomerizzano mediante riarrangiamenti sigmatropici [3,3] al riscaldamento. Reazione nota come riarrangiamento di Cope. Il riarrangiamento degli 1,5-dieni N-sostituiti è chiamato riarrangiamento aza-Cope. A seconda della posizione occupata dall'azoto abbiamo: 1-aza-, 2-aza-, 3-aza-Cope. Il raggruppamento 3-aza-Cope coincide con l'aza-Claisen.
- Dettagli
- Germán Fernández
- REAZIONI IN CHIMICA ORGANICA
- Visite: 8935
Reazione analoga al riarrangiamento di Wittig, in cui gli eteri di metalli alfa riorganizzano gli alcossidi, generando alcoli secondari o terziari dopo l'idrolisi. Nel caso di aza-[2,3]-Wittig, si tratta di ammine terziarie alliliche metallizzate alfa che producono ammine secondarie dopo l'idrolisi.

- Dettagli
- Germán Fernández
- REAZIONI IN CHIMICA ORGANICA
- Visite: 19442
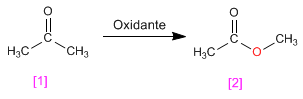
L'ossidazione Baeyer Villiger permette la trasformazione dei chetoni in esteri.
- Dettagli
- Germán Fernández
- REAZIONI IN CHIMICA ORGANICA
- Visite: 8891
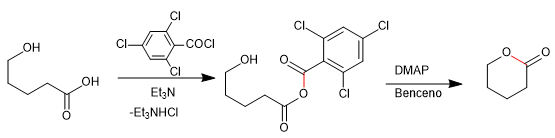
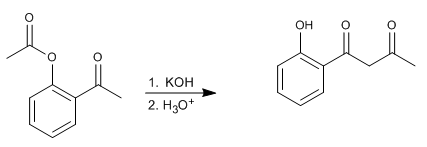
Il riarrangiamento Baker-Venkataraman trasforma gli orto-acilossichetoni aromatici in beta-dichetoni mediante trattamento basico (catalisi). I beta-dichetoni sono di grande interesse nella sintesi di cromoni, flavoni e cumarine. Le basi più comunemente utilizzate nella reazione sono: KOH, potassio terz-butossido, sodio in toluene, idruro di potassio.
- Dettagli
- Germán Fernández
- REAZIONI IN CHIMICA ORGANICA
- Visite: 11498
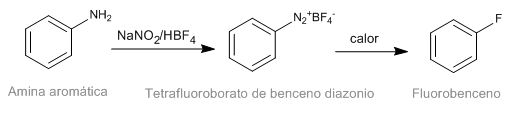
La reazione di Schiemann consiste nella decomposizione termica di tetrafluoroborati di diazonio aromatico per produrre il corrispondente derivato fluorurato. Sebbene i sali di diazonio siano intestabili, i tetrafluoroborati di diazonio hanno una stabilità significativa e possono essere preparati con una buona resa. Il tetrafluoroborato di diazonio viene preparato da ammine aromatiche mediante la reazione di diazotizzazione.
- Dettagli
- Germán Fernández
- REAZIONI IN CHIMICA ORGANICA
- Visite: 18501
Tosilidrazoni di aldeidi o chetoni alifatici reagire con basi forti per dare alcheni . 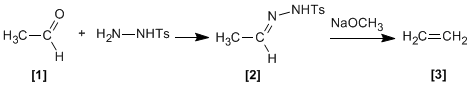
- Dettagli
- Germán Fernández
- REAZIONI IN CHIMICA ORGANICA
- Visite: 9777
La reazione di Barbier consente di ottenere reagenti organometallici instabili nel mezzo di reazione. Inizialmente è stato realizzato con il magnesio metallico, generando magnesio in situ. Successivamente è stato esteso ad altri metalli: Sn, Zn..., potendo lavorare in mezzi acquosi, senza richiedere la protezione dei gruppi acidi (ossidrili).
- Dettagli
- Germán Fernández
- REAZIONI IN CHIMICA ORGANICA
- Visite: 14611
- Dettagli
- Germán Fernández
- REAZIONI IN CHIMICA ORGANICA
- Visite: 16893
aldeidi e chetoni reagire con composti a, b -insaturi in presenza di ammine terziarie che fungono da catalizzatori, per formare prodotti a -idrossialchilati .
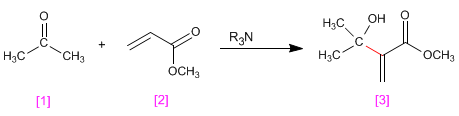
- Dettagli
- Germán Fernández
- REAZIONI IN CHIMICA ORGANICA
- Visite: 14847
La reazione di Beckmann produce il riarrangiamento di un'ossima in un'ammide. Questa reazione viene condotta in un mezzo acido.
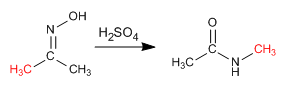
- Dettagli
- Germán Fernández
- REAZIONI IN CHIMICA ORGANICA
- Visite: 10388
La reazione Blanc permette la clorometilazione dei composti aromatici.
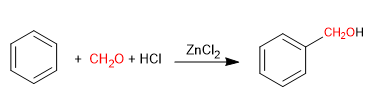
Utilizza come reagenti metano con acido cloridrico gassoso in presenza di un acido di Lewis. Il risultato è l'introduzione di un gruppo idrossimetilico sull'anello aromatico (benzene) il cui ossidrile è sostituito dal cloro in presenza di acido cloridrico.
- Dettagli
- Germán Fernández
- REAZIONI IN CHIMICA ORGANICA
- Visite: 21762
Le aldeidi, prive di idrogeni alfa, danno la reazione di Cannizzaro per trattamento con una base forte (NaOH)
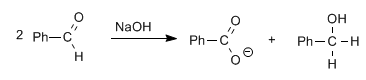
In questa reazione una molecola viene ridotta ad alcool, mentre l'altra viene ossidata ad acido carbossilico.
- Dettagli
- Germán Fernández
- REAZIONI IN CHIMICA ORGANICA
- Visite: 11607
La reazione di Chugaev consente la formazione di olefine dagli xantani.
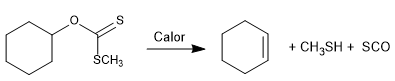
- Dettagli
- Germán Fernández
- REAZIONI IN CHIMICA ORGANICA
- Visite: 19945
La condensazione di Claisen comporta la reazione degli esteri in terreno basico formando 3-chetoesteri
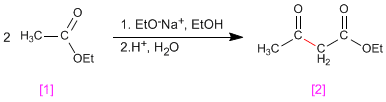
- Dettagli
- Germán Fernández
- REAZIONI IN CHIMICA ORGANICA
- Visite: 34057
In questa reazione due alcheni E sono trattati con un metallo di transizione che funge da catalizzatore, dando una miscela di alcheni (compresi gli isomeri Z/E). Questo prodotto è ottenuto per scambio di gruppi alchilidenici. 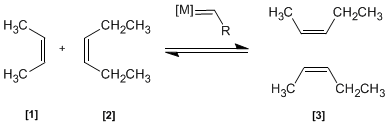
- Dettagli
- Germán Fernández
- REAZIONI IN CHIMICA ORGANICA
- Visite: 16104
La reazione di Barton produce 4-nitrosoalcoli dai nitriti mediante irraggiamento con luce ultravioletta.
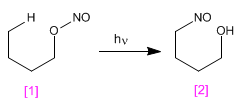
- Dettagli
- Germán Fernández
- REAZIONI IN CHIMICA ORGANICA
- Visite: 23497
I tosilidrazoni di aldeidi o chetoni reagire con due equivalenti di organolitico per generare un intermedio anionico in grado di subire processi di alchilazione.
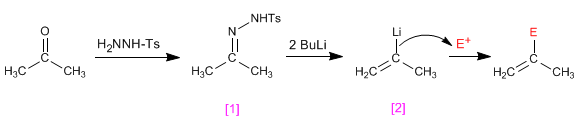
- Dettagli
- Germán Fernández
- REAZIONI IN CHIMICA ORGANICA
- Visite: 7583
La sintesi di Wharton consente di trasformare gli α,β-epossichetoni in alcoli allilici mediante trattamento con idrazina in acido acetico medio o idrazina idrato seguita da base forte. L'\alfa,\beta-epossichetone si ottiene dal chetone \alfa,\beta-insaturo mediante ossidazione con perossido di idrogeno in un mezzo basico.
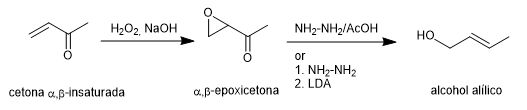
Leggi tutto: Sintesi di Wharton delle olefine (riarrangiamento di Wharton)
- Dettagli
- Germán Fernández
- REAZIONI IN CHIMICA ORGANICA
- Visite: 13823
L'ossidazione Wacker permette la trasformazione degli alcheni nei corrispondenti chetoni mediante trattamento con Pd in presenza di sali di rame. Il rame ha la capacità di ossidare il palladio (0) in palladio (II), quest'ultimo essendo l'agente catalitico nella reazione.
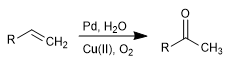
- Dettagli
- Germán Fernández
- REAZIONI IN CHIMICA ORGANICA
- Visite: 12512
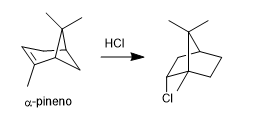
- Dettagli
- Germán Fernández
- REAZIONI IN CHIMICA ORGANICA
- Visite: 16388
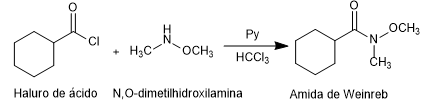
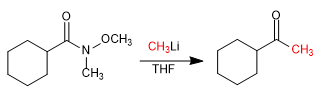
- Dettagli
- Germán Fernández
- REAZIONI IN CHIMICA ORGANICA
- Visite: 8767
La frammentazione di Wharton è una reazione concertata in cui un gruppo uscente si trova in posizione 4 rispetto a un gruppo donatore di elettroni. Il trasferimento delle coppie libere del gruppo donatore produce la frammentazione del legame confinante e la perdita del gruppo uscente con la formazione di doppi legami. Vediamo un esempio:
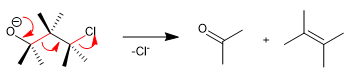
- Dettagli
- Germán Fernández
- REAZIONI IN CHIMICA ORGANICA
- Visite: 8588
Nel 1902, Wolff osservò che il trattamento del diazoacetofenone (α-diazoketone) con Ag 2 O/H 2 O produceva un riarrangiamento che generava acido fenilacetico.
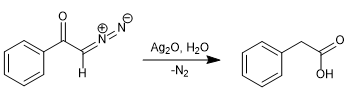
Sostituendo l'acqua con l'ammoniaca si ottiene la fenilacetammide.
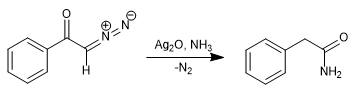
- Dettagli
- Germán Fernández
- REAZIONI IN CHIMICA ORGANICA
- Visite: 15688
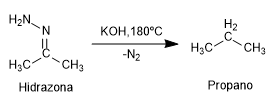
- Dettagli
- Germán Fernández
- REAZIONI IN CHIMICA ORGANICA
- Visite: 23818
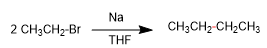
- Dettagli
- Germán Fernández
- REAZIONI IN CHIMICA ORGANICA
- Visite: 11494