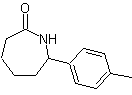
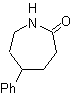
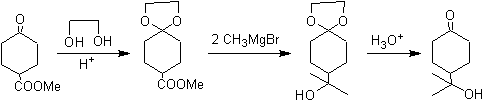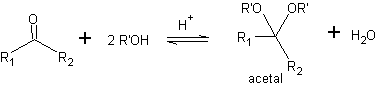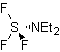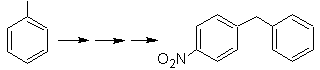SÍNTESE ORGÂNICA
- Detalhes
- Wilbertrivera
- SÍNTESE ORGÂNICA
- Acessos: 44630
METODOLOGIAS DE SÍNTESE ORGÂNICA
A síntese total de um composto orgânico exigiria partir cada vez dos elementos que o compõem. No entanto, é bem conhecido que compostos orgânicos simples como ureia, metano, metanol, acetileno, ácido acético, etanol podem ser obtidos a partir dos elementos, e assim por diante, estruturas cada vez mais complexas podem ser construídas.
No entanto, isso não é prático nem necessário, pois há um grande número de compostos orgânicos disponíveis comercialmente ou economicamente disponíveis e que podem ser usados como materiais de partida. A rigor, todos eles derivam dos elementos que os compõem ou deles podem ser derivados, portanto qualquer síntese que se faça a partir dessas matérias-primas será “formalmente” uma síntese total.
As metodologias de síntese para enfrentar uma síntese bem-sucedida foram mudando com o passar do tempo e o desenvolvimento da própria química como ciência, daí se conhecer:
- Metodologia da “associação direta”
- Metodologia da “abordagem intermediária”
- Metodologia da "análise lógica"
- Detalhes
- Wilbertrivera
- SÍNTESE ORGÂNICA
- Acessos: 29617
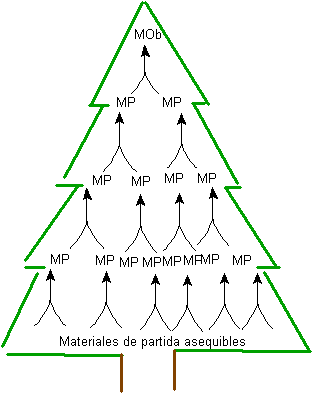
A elaboração de uma " árvore de síntese " baseada na geração de moléculas intermediárias ou precursoras, passo a passo na direção antitética (retrossíntese), ou seja, a partir da molécula objetivo, constitui um método que pode ser melhor compreendido considerando os seguintes princípios gerais do referido processo.
1. Comece com a estrutura final (MOb). A partir da estrutura final, a molécula-alvo, trabalha de trás para frente (retrossíntese) até obter matérias-primas facilmente acessíveis. Se a matéria-prima inicial for especificada no problema de síntese, isso apenas limitará o número de possíveis rotas sintéticas a serem abordadas.
2. Caracterização da molécula alvo (MOb ). Ao examinar a estrutura da molécula alvo, é necessário responder às seguintes perguntas:
para. Que tipo de composto é?
b. Que grupo(s) funcional(is) ele contém?
c. Qual é a natureza do esqueleto de carbono?
d. A molécula tem uma cadeia alquila normal ou ramificada?
e. Contém anéis e eles são cicloalquil ou aromáticos?
F. O MOb tem simetria real ou potencial?
3. O Grupo Funcional . Nesse sentido, também será bom responder às seguintes perguntas:
para. É conhecida a reatividade, sensibilidade e instabilidade dos grupos funcionais que o MOb possui?
b. Que métodos gerais estão disponíveis para sua preparação?
c. Qual deles é aplicável ao grupo funcional específico da molécula do problema?
4. Aspectos estereoquímicos . Será analisado no MOb, preferencialmente:
para. centros quirais
b. Modelagem e configuração de anéis
c. Efeitos de proximidade entre grupos
5. O esqueleto carbonático . O principal problema na maioria das sínteses orgânicas é a construção do esqueleto de carbono. A troca de grupos funcionais (IGFs) geralmente é simples de fazer, como cetona para álcool, aldeído para ácido ou álcool para brometo. As questões que se colocam relativamente à construção dos links CC relacionam-se com as que já foram colocadas relativamente ao grupo funcional.
para. Alguns dos métodos disponíveis para formar grupos funcionais são aplicáveis para gerar links CC?
b. O método é compatível com o esqueleto de carbono específico da molécula alvo? Se não é.
c. Existe um procedimento para formar uma cadeia de carbono que produza uma função conversível para a necessária?
6. Moléculas Precursoras (PM)
A análise da estrutura da molécula problemática e a consideração das questões colocadas nos passos 1) a 5) darão origem a dois tipos possíveis de moléculas precursoras. Um deles contém um grupo funcional equivalente ao da estrutura final.
O outro é um composto com menos átomos de carbono do que a molécula alvo. Quando estes últimos são reunidos, a cadeia de carbono final e a funcionalidade necessária são alcançadas.
A geração de qualquer um desses tipos de moléculas precursoras deve resultar em uma simplificação do problema.
Em geral, se um caminho projetado leva a precursores mais difíceis de sintetizar do que o próprio problema (alvo), outro caminho deve ser buscado.
Fig. 1. ÁRVORE DE SÍNTESE
A geração de moléculas precursoras, até chegando aos materiais de partida, gera uma série de estruturas, que juntas formam uma espécie de árvore, fig.1. É daí que vem o nome do método sintético.
- Detalhes
- Wilbertrivera
- SÍNTESE ORGÂNICA
- Acessos: 35816
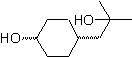
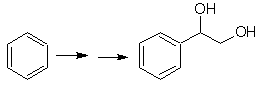
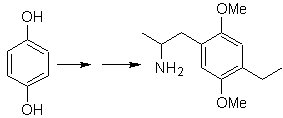
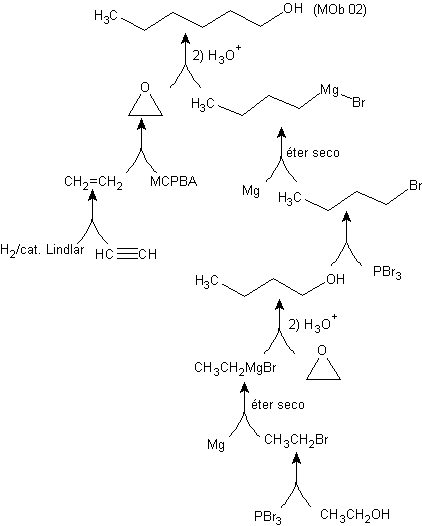
Síntese de n-hexanol ( MOb 02)
Solução : O n-hexanol (MOb 02) é um álcool primário, cuja cadeia carbônica não possui ramificações. Portanto, a estratégia se reduz a buscar reações que permitam o crescimento da cadeia em um bom número de átomos de carbono. Não é aconselhável que o crescimento da cadeia seja um a um, pois esse caminho levaria a um plano de síntese com muitas etapas, conseqüentemente um baixo rendimento.
Assim, a abertura de anéis epóxido por um composto de Grignard pode ser adequada para este fim; como também pode ser combinado com síntese acetilênica (uso de derivados de acetileto de sódio e posterior saturação da ligação tripla).
O epóxido necessário para combinar com o Grignard é preparado a partir de um alceno e um ácido perácido. Assim, deduz-se o presente plano de síntese, onde as matérias-primas podem ser acetileno e o etanol.
Ler mais: Problemas de síntese, resolvidos pelo método Synthesis Tree
- Detalhes
- Wilbertrivera
- SÍNTESE ORGÂNICA
- Acessos: 40727
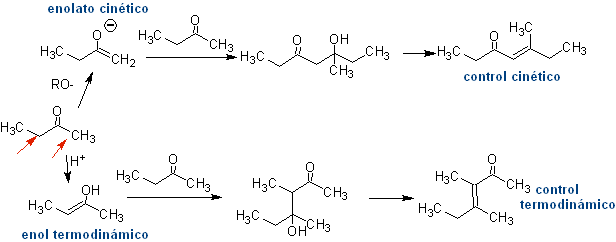
Formação de enóis e enolatos
O carbono alfa de compostos contendo o grupo carbonila (aldeídos, cetonas, ésteres, dicetonas, diésteres, nitratos, nitrilas, etc.) é o centro de muitas reações de formação de ligações CC. Devido à acidez do H a , sofrem uma -desprotonação na presença de uma base adequada, com a consequente formação de um carbânion. A carga negativa resultante em C a para C=O é estabilizada por ressonância pelo mesmo grupo carbonila.
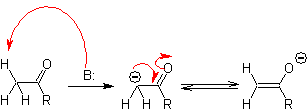
A seleção da base, para a formação de enolatos, está condicionada ao fato de que o pKa do ácido conjugado da base deve ser maior em pelo menos três unidades que o pKa do composto carbonílico que possui H 's ácidos .
| pK a = 20 | MeO- pK a = 15 | Formação de enolato desfavorável |
| pK a = 10 | tBuO- _ pK a = 19 | Formação de enolato muito favorável |
Formação de enolatos:
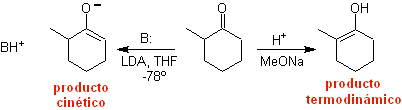
¨ O enolato cinético
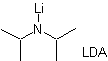
Isso ocorre porque o substrato possui H α , facilmente acessível para desprotonação através de uma base típica como LDA (pKa
Aproximadamente 30) LDA (diisopropilamida de lítio) é uma base forte, não nucleofílica, estericamente impedida. |
|
¨
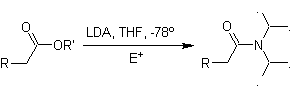
Enolatos de ésteres:
Os ésteres são suscetíveis a uma reação de substituição da base, O LDA pode ser problemático, e é por isso que a base não nucleofílica (isopropilciclohexilamida de lítio) é usada com ésteres.
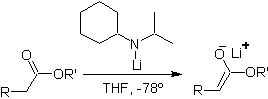
¨
Enolato termodinâmico:
Uma desprotonação reversível pode levar a enolatos mais estáveis, o que ocorre quando o C=C mais substituído da forma enol é obtido.
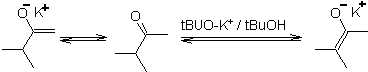
As condições típicas para formar enolatos termodinâmicos são: RO-M+ em ROH como solvente prótico (pKa de ROH = 15 a 18).
Os enolatos cinéticos e termodinâmicos podem ser capturados, isolados, separados e purificados para obter enolatos regioquimicamente puros. Isso pode ser conseguido pela formação de acetatos de éter enol e silileno.
- Detalhes
- Wilbertrivera
- SÍNTESE ORGÂNICA
- Acessos: 44845
Reações de Enóis e Enolatos
Reações aldólicas e as chamadas reações de condensação de compostos carbonílicos e outros desse tipo, que podem formar estruturas enol e enolato, participam de um grande grupo de reações importantes que permitem entender a existência de um imenso número de moléculas resultantes da interação de enóis ou enolatos com uma série de grupos eletrofílicos.
O estudo deste tipo de reação permitiu verificar e estabelecer a existência de dois mecanismos de reação através dos quais ocorrem, conforme explicado a seguir:
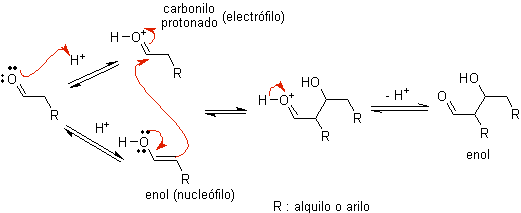
PARA)
Quando o ácido é usado como catalisador, o composto carbonílico é inicialmente protonado e depois tautomerizado em sua forma enol , que é um nucleófilo no carbono alfa para o grupo carbonila. O mesmo meio ácido é suficiente para ativar o grupo carbonila de outra molécula, tornando-a altamente eletrofílica, o que gera condições ótimas para produzir um composto carbonílico insaturado.
A reação segue normalmente até a desidratação do enol formado, catalisada pelo mesmo ácido da reação.
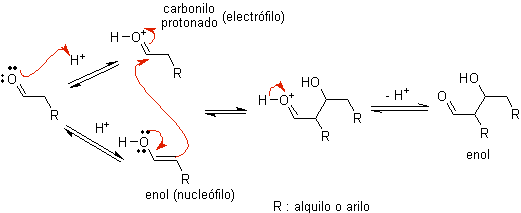
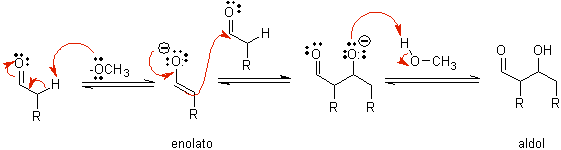
B) Quando o catalisador é uma base, como um alcóxido, a reação do tipo aldólica prossegue por meio do ataque nucleofílico do enolato estabilizado por ressonância ao grupo carbonila de outra molécula.
Por desidratação do aldol, catalisada por base, forma-se o produto final desidratado.
Como no caso anterior, a desidratação catalisada por base (às vezes escrita como uma única etapa), permite controlar a reação e produzir um produto final desidratado. Em alguns casos, a formação de enolatos é irreversível.
Como se vê apenas uma quantidade catalítica de base é necessária em alguns casos, o procedimento mais usual é usar uma quantidade estequiométrica de base forte comoLDA ou NaHMDS . Nesse caso, a formação de enolato é irreversível e o produto aldólico não é formado até que o alcóxido de metal do produto aldólico seja protonado em uma etapa posterior.
- Detalhes
- Wilbertrivera
- SÍNTESE ORGÂNICA
- Acessos: 34816
A síntese orgânica, coração da química orgânica , é uma atividade essencialmente heurística , ou seja, é um processo onde se fundem as atividades criativas altamente preditivas do pensamento lógico e dos procedimentos empíricos, ricos em elaboração artística, tornando o químico orgânico um verdadeiro inovador.
Como qualquer método, o “ método da desconexão ou sinthon ” possui estrutura, simbologia e linguagem próprias, que devem inicialmente ser assimiladas e compreendidas por quem se dispõe a utilizar esta ferramenta sintética.
O método de síntese das desconexões ou synthon , inclui Duas fases;
![]() Fase de análise retrossintética . Mostra todas as transformações que serão realizadas no processo de simplificação da estrutura de
Fase de análise retrossintética . Mostra todas as transformações que serão realizadas no processo de simplificação da estrutura de
![]() Fase de síntese . Onde o que é “pensado”, baseado em critérios de racionalidade mecanicista e reatividade dos compostos orgânicos, se materializa em uma rota de síntese, que será escrita, como se espera que ocorra no laboratório químico. É onde a experiência emerge e manifesta a " arte de fazer ou inventar ”do químico, ou seja,
Fase de síntese . Onde o que é “pensado”, baseado em critérios de racionalidade mecanicista e reatividade dos compostos orgânicos, se materializa em uma rota de síntese, que será escrita, como se espera que ocorra no laboratório químico. É onde a experiência emerge e manifesta a " arte de fazer ou inventar ”do químico, ou seja,
O termos, definições ou operações de síntese, recorrentemente utilizados neste método, são os seguintes:
Molécula Alvo (MOb) .
Este é o nome dado a qualquer molécula que se pretende sintetizar ou preparar a partir de materiais simples e acessíveis, que em um problema podem ser previamente definidos ou ajustados às opções que o químico gera em seu plano ou projeto de síntese.
transformação . ( ![]() ).
).
A seta especial de retrossíntese unidirecional deve ser entendida como uma representação simbólica da expressão “ é preparado de ” e também representa algum tipo de transformação na estrutura de
Os tipos de transformação referidos são na verdade operações retrossintéticas como: Desconexões, Reconexões, Rearranjos, Interconversão de Grupos Funcionais (IGF), Adição de Grupos Funcionais (AGF), Deleção de Grupos Funcionais (SGF), etc.
Desconexão.
É uma operação retrossintética que representa a quebra imaginária das ligações químicas que teriam sido formadas na molécula alvo, a partir dos síntons ou mais precisamente de seus equivalentes sintéticos (moléculas precursoras), postuladas.
Pode ser entendido como o inverso de uma reação química, é representado por uma seta (bem diferente de uma reação química ou condições de equilíbrio) e uma linha ondulada cruzada sobre a ligação que será "desconectada".
É ainda possível colocar a desconexão proposta na seta: CC, CS. CX, CO, CN. etc. Expressões que nos ligam ao tipo de reação que será utilizada, na formação de
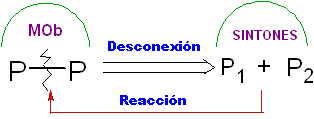
Em outros casos, o modelo de desconexão que está sendo utilizado pode ser escrito, por exemplo, é comum encontrar: 1, 3-diO, 1,4 –diCO, 1,5-diCO ou α, β -insatCO . etc.
Portanto, em uma molécula dioxigenada, pode-se esperar que ocorram as seguintes desconexões:
![]() desconexões heterolíticas,
desconexões heterolíticas,
![]() Desconexões homolíticas ou radicais
Desconexões homolíticas ou radicais
![]() Desconexões Eletrocíclicas
Desconexões Eletrocíclicas
![]() Reordenar desconexões
Reordenar desconexões
- Detalhes
- Wilbertrivera
- SÍNTESE ORGÂNICA
- Acessos: 26683
DESCONEXÕES DE COMPOSTOS DE 1,3-DIOXIGÊNIO
Os compostos orgânicos oxigenados são os mais abundantes na natureza e particularmente os dioxigenados, razão pela qual muitos pesquisadores químicos modelaram a desconexão retrossintética dessas moléculas, aspecto que será estudado nos parágrafos seguintes.
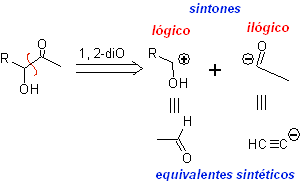
Para começar, os modelos de desconexão de moléculas dioxigenadas foram divididos em dois grandes grupos, com base na natureza dos síntons que são gerados com a aplicação de uma operação sintética básica chamada " DESCONEXÃO" à molécula a ser sintetizada e que geralmente é referido como uma molécula alvo (MOb) .
Esses grandes grupos são:
![]() Modelos de desconexão “ lógica ” e
Modelos de desconexão “ lógica ” e
![]() Modelos de desconexão “ anômalos ” ou “ ilógicos ”
Modelos de desconexão “ anômalos ” ou “ ilógicos ”
Os chamados modelos de desconexão "lógica" são aqueles que, aplicando uma "desconexão" de uma ou várias ligações químicas em
Compostos que podem ser classificados como 1,3-dioxigênio e 1,5-dioxigênio, quando submetidos à retrossíntese, geralmente formam sintões considerados "lógicos". Por outro lado, moléculas orgânicas relacionadas ao 1,2-dioxigenado, 1,4-dioxigenado e 1,6-dioxigenado, geram síntons
considerado “ilógico”
Modelo de corte 1,3-dioxigênio
![]() compostos β-dicarbonil
compostos β-dicarbonil
Os compostos 1,3-dicarbonil são obtidos com bons rendimentos através de reações de condensação do tipo Claisen, que envolvem a reação entre ésteres e compostos com hidrogênios ativos, tais como: ésteres, cetonas, aldeídos, nitrilas, nitroderivados e alguns hidrocarbonetos na presença de reagentes alcalinos.
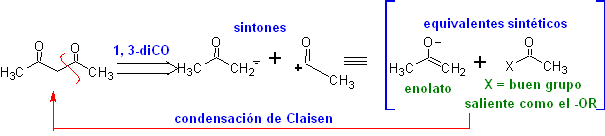
As β-dicetonas e β-cetoaldeídos são obtidos pela condensação cruzada de Claisen, usando uma cetona e um éster adequados. Na condensação cruzada de Claisen de cetonas e ésteres, bons rendimentos são obtidos porque as cetonas são notavelmente mais ácidas que os ésteres, portanto, no meio básico, a cetona é desprotonada em maior grau do que o éster.
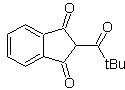
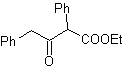
Exemplos : Proponha um projeto de síntese a partir de materiais simples, para as seguintes moléculas:
MOb 16
| turba 17
| MOb 18
|
Solução:
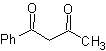
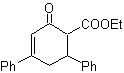
MOb 16 . Aparentemente as duas alternativas de desconexão (a) e (b), mostradas na
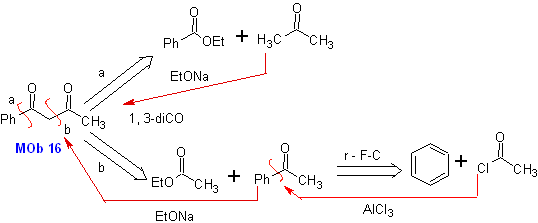
Porém, a alternativa (b) acaba sendo a mais adequada, pois, no meio reacional básico, o carbânion formado PhCOCH 2 - estaria melhor estabilizado, devido à ressonância e aos efeitos indutivos.
- Detalhes
- Wilbertrivera
- SÍNTESE ORGÂNICA
- Acessos: 24504
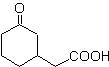
Os compostos 1,5-dioxigenados são geralmente o resultado de reações de adição conjugada de nucleófilos de compostos carbonílicos, com ácidos H α (enóis, enolatos, enaminas, etc.), bem como nitrilas e nitratos, em substratos alfa beta insaturados em relação a grupos carbonila e semelhantes, conhecida como reação de Michael, com opções complementares sendo a reação de Nef e a reação de anulação de Robinson (anulação).
Desconecte o modelo 1, 5 dioxigênio (1,5-diO)
O modelo de desconexão do 1,5-diO pode ser aplicado, após a necessária funcionalização, a compostos como: 1,5-diidroxilos, 1,5-hidroxialdeídos, 1,5-hidroxicetonas, 1,5-hidroxiésteres, 1,5- cetoaldeídos, 1,5-dicetonas, 1,5-cetoésteres, 1,5-dialdeídos, etc.
As possibilidades aumentam se também forem levados em consideração os nitroderivados e nitrilas, que podem formar carbânions muito reativos em um meio básico capaz de se somar a compostos carbonílicos α,β-insaturados para obter produtos do tipo 1,5-diO.
A análise fundamental da desconexão dos compostos 1,5-diO é a seguinte:
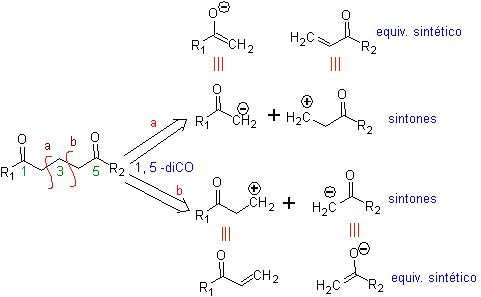
A escolha da desconexão (a) ou (b), em torno de C3, dependerá da natureza dos grupos R1 e R2, que podem conferir maior ou menor estabilidade ao sínton ou equivalente sintético necessário para a formação de
Proponha um projeto de síntese para MOb 29, 30 e
MOb 29
| MOb 30
| MOb 31
|
Solução:
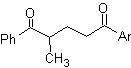
MOb 29 . Análise retrossintética: O carbânion necessário para adicionar ao composto a , b -insaturado CO Pode ser obtido a partir de malonato de dietila em meio básico. O que posteriormente forçará uma descarboxilação, para atingir
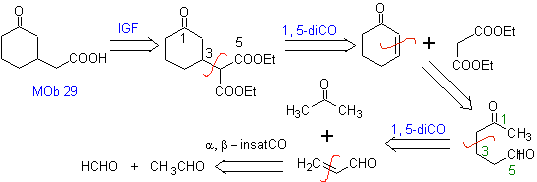
- Detalhes
- Wilbertrivera
- SÍNTESE ORGÂNICA
- Acessos: 59971
A operação de proteção requer o seguinte procedimento:
·
Proteja o(s) grupo(s) funcional(is) mais reativo(s) seletivamente e sob condições brandas.
·
Realize a reação no grupo funcional necessário sem afetar o grupo protegido
·
Grupo funcional desprotegido, sujeito a proteção
O ação de proteção deve satisfazer os seguintes requisitos básicos:
·
A reação deve funcionar bem e ser quimiosseletiva.
·
O novo grupo funcional deve ser estável nas condições de reação do grupo que irá reagir.
·
A funcionalidade introduzida não deve adicionar centros quirais à molécula que podem gerar diasterómeros
·
O grupo funcional original deve poder ser regenerado com bom rendimento e sem afetar o resto da molécula.
O uso de protetores deve ser reduzido ao mínimo essencial e sua escolha deve ser feita de forma que não precisem ser substituídos ao longo da síntese, pois as etapas de introdução e remoção (desproteção) agregam custo e trabalho à síntese e diminuem o rendimento. Exemplo.
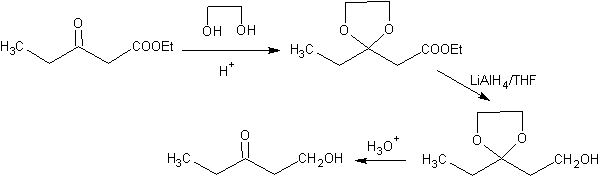
O grupo cetônico da molécula foi protegido transformando-o em um cetal cíclico, com um etanodiol em meio levemente ácido, posteriormente esta molécula foi reagida com dois moles de brometo de fenilmagnésio, que atua no grupo éster, para transformá-lo em um álcool terciário, com dois substituintes metil contribuídos pelo Grignard. Finalmente, o cetal cíclico é hidrolisado para regenerar a cetona.
Na prática, não existe um grupo de proteção perfeito para cada funcionalidade, mas pode-se afirmar que existe uma grande bateria de protetores possíveis, cada um dos quais atende às condições acima em determinadas circunstâncias. Uma pequena lista de proteção dos grupos mais comuns está incluída nas seguintes seções:
PROTEÇÃO CONTRA ALDEÍDOS E CETONAS
Uma forma de proteger cetonas e aldeídos é a sua conversão em acetais. Os acetais podem ser desprotegidos em condições brandas por reações de hidrólise ácida.
Na redução de um cetoéster a cetoálcool. A proteção da cetona na forma de um acetal é muito conveniente porque o acetal resiste às condições redutoras sob as quais será usado na conversão do grupo éster em um grupo hidroxila.
O esquema a seguir mostra a sequência de síntese completa que permite alcançar a redução do éster sem afetar a cetona:
Na primeira etapa, a cetona é convertida em um acetal cíclico por reação com etileno glicol na presença de um catalisador ácido. Na segunda etapa, o éster é reduzido com LiAlH 4 . Este reagente não ataca o acetal. Por fim, na terceira etapa, o álcool-acetal é tratado em meio aquoso ácido. Nessas condições, o acetal é hidrolisado, regenerando o grupo cetônico carbonila. Cada uma das três etapas é quimiosseletiva, pois em cada uma delas é alcançada a reação preferida de um grupo funcional.
na presença de outro.
- Detalhes
- Wilbertrivera
- SÍNTESE ORGÂNICA
- Acessos: 28277
O controle na síntese orgânica é uma das tarefas mais importantes para alcançar a transformação necessária ou planejada. e/ou evitar a formação daqueles subprodutos que prejudicam substancialmente o desenvolvimento ideal da síntese orgânica em questão. Da mesma forma, em uma perspectiva mais geral, o controle também pode incluir ou abranger os aspectos de simetria e seletividade.
Então, o controle deve ser entendido como uma série de operações sintéticas que permitem ao químico formar o esqueleto de carbono com a funcionalidade pretendida ou "colocar" um grupo ou átomo no local ou posição necessária.
Consequentemente, essas operações podem ser de uma gama variada de rotinas com uma intenção refletida pelo químico e que exigem certas habilidades cognitivas e habilidades semelhantes às artísticas, para a construção (síntese) de moléculas orgânicas.
Portanto, nas reações de condensação, como em outras, as operações de controle podem ser incluídas em uma das seguintes categorias.
![]() Reações competitivas (autocondensação e/ou condensação cruzada)
Reações competitivas (autocondensação e/ou condensação cruzada)
![]() Ativação – desativação
Ativação – desativação
![]() Seletividade e especificidade
Seletividade e especificidade
![]() Proteção-desproteção
Proteção-desproteção
Nas reações de condensação de compostos carbonílicos, é essencial estabelecer previamente a ordem dos eventos para minimizar ou, se necessário, suprimir as possibilidades de autocondensação e a ocorrência de condensação cruzada, que infelizmente são uma ameaça evidente nessas reações. .
autocondensação
Todos os compostos carbonílicos que possuem um ou mais hidrogênios alfa, nos carbonos adjacentes ao grupo carbonílico, correm o risco de sofrer uma reação de autocondensação se o rigor correspondente não for seguido.
Assim, por exemplo, se uma base não hidroxilada como a EtONa for adicionada a uma 2-butanona, forma-se um enolato que pode eventualmente combinar-se com outra molécula da mesma cetona. Da mesma forma, se H+ for adicionado, a autocondensação também pode ocorrer, como pode ser visto no esquema a seguir: Isso pode ser minimizado adicionando na mesma taxa, de alimentadores separados, a base ou ácido ao composto que fornecerá o enol ou enolato e o composto carbonílico que será atacado no carbono carbonílico . Um balão de três tubuladuras e agitação magnética podem ser usados.
condensação cruzada
Idealmente, em reações de condensação de compostos carbonílicos, uma das moléculas reagentes deve enolizar rapidamente, enquanto a outra deve preferencialmente não ter Hα. , para garantir que nenhum outro subproduto seja formado
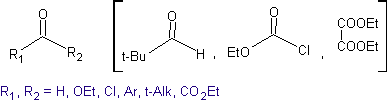
A retrossíntese que se analisa a seguir é um bom exemplo do que foi indicado anteriormente.
- Detalhes
- Wilbertrivera
- SÍNTESE ORGÂNICA
- Acessos: 25018
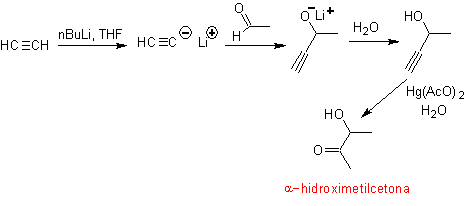
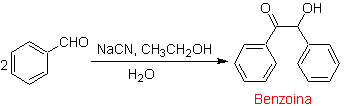
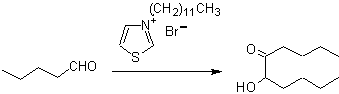
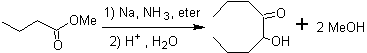

- Detalhes
- Wilbertrivera
- SÍNTESE ORGÂNICA
- Acessos: 25678
DESCONEXÃO DE COMPOSTOS DE 1,4-DIOXIGÊNIO
Outro grupo de compostos de grande importância na síntese química é formado por moléculas dioxigenadas que se encontram em uma razão de distância de 1,4. Esses compostos, quando submetidos a uma análise de desconexão retrossintética, geram síntons, onde um deles, o eletrófilo ou nucleófilo, pode ser considerado "anômalo" ou "ilógico", pois a carga atribuída a um dos átomos não pode ser explicada em termos de sua eletronegatividade intrínseca ou induzida.
1. Compostos de 1,4-dioxigênio (1,4-diO)
Neste tipo de compostos, a desconexão conduz também a um sínton lógico e a outro sínton ilógico (não natural), que pode ser um nucleófilo ou um eletrófilo, cujo equivalente sintético ainda tem de ser adequadamente retrabalhado, para poder ser utilizado em a reação química.
1. 1. Compostos 1,4-dicarbonil
1.1.1. compostos de 1,4-dicetona
As alternativas de desconexão deste tipo de compostos ou moléculas a sintetizar (MOb) podem conduzir às seguintes opções:
para. Um sínton de ânion lógico e um sínton de cátion ilógico
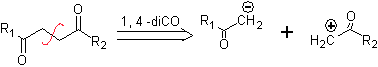
O equivalente sintético do ânion é o íon enolato ou o próprio enol do composto carbonílico. Em vez disso, o equivalente sintético para o carbocátion é o alfa-halocarbonil. (Umpoloung)
b. Um sínton de cátion lógico e um sínton de ânion ilógico
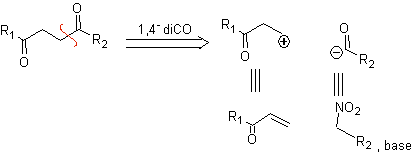
O equivalente sintético do sínton catiônico lógico é o composto carbonílico α,β-insaturado. Um equivalente sintético adequado para o ânion sínton pode ser um ânion nitroalcano. O grupo –NO 2 em alcanos pode ser transformado em C=O, por meio da reação de Nef, ou pelas variantes da reação de McMurry, onde por ação do TiCl 3, o nitroalcano é transformado em uma imina, que é então é hidrolisado em meio ácido ao respectivo composto carbonílico.
1.1.2.
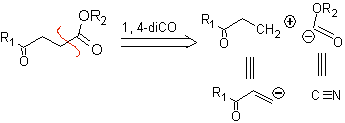
compostos 1,4-cetoéster
γ-cetoésteres, 1,4-diésteres e 1,4-diácidos podem ser desconectados a um sínton catiônico natural, cujo equivalente sintético é um composto carbonílico α,β-insaturado, e ao não natural (“ilógico” ) ânion sínton (-) COOR, cujo equivalente sintético é o íon cianeto.
Exemplos: Proponha um projeto de síntese, a partir de materiais simples e acessíveis, para cada uma das seguintes moléculas:
MOb 35
| MOb 36
| |
MOb 37
| MOb 38
|
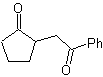
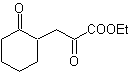
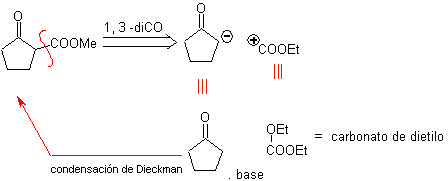
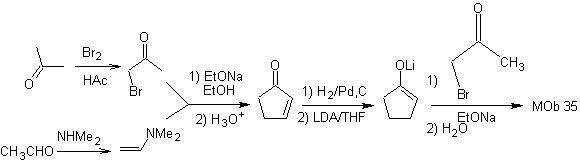
MOb 35 (a). Análise retrossintética . A molécula pode ser desconectada de acordo com o modelo 1,4-diCO. A ciclopentanona precursora gerada deve ser previamente ativada para que seu Cα seja mais nucleofílico, e então ser usado na reação com α.bromoacetona.
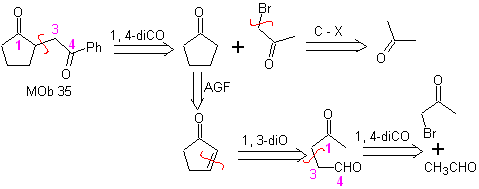 síntese . A nucleofilicidade da ciclopentanona é controlada e garantida, usando LDA, para chegar a
síntese . A nucleofilicidade da ciclopentanona é controlada e garantida, usando LDA, para chegar a
- Detalhes
- Wilbertrivera
- SÍNTESE ORGÂNICA
- Acessos: 20934
Os compostos 1,6-difuncionalizados utilizam preferencialmente a estratégia de reconexão para suas respectivas sínteses; Essa estratégia pode muito bem ser combinada com a reação de Diels-Alder, que geralmente produz adutos olefínicos de seis membros, ou a redução de anéis de benzeno de Birch, que também gera produtos olefínicos de seis membros.
1.
compostos 1,6-dioxigenados
A reação que gera compostos dicarbonílicos, de diferentes combinações possíveis: dicetonas, cetoácidos, cetoaldeídos, diácidos, etc. e a diferentes distâncias entre si, é sem dúvida a reação de ozonólise de compostos olefínicos.
Dependendo da estrutura do substrato e das condições de reação no intermediário ozonídico formado, uma enorme diversidade de compostos será obtida como resultado da clivagem da dupla ligação olefínica. Destas, as que estão na proporção 1,6 – dioxigenadas são de especial interesse, como se pode inferir da seguinte operação sintética de “religação”:
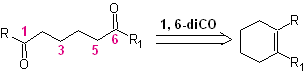
A melhor maneira de entender o funcionamento dessa "operação de reconexão sintética" é
será alcançado através da solução da síntese das seguintes moléculas orgânicas:
MOb 50
| MOb 51
| MOb 52
| ||
MOb 53
| MOb 54
| MOb 55
|
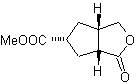
MOb 50 . Análise retrossintética : Em primeiro lugar, é desconectado pela função lactona da molécula. Já na molécula precursora gerada, pode -se argumentar que sua formação pode ter ocorrido a partir do ácido diacarboxílico na posição 1-6. Que são reconectados para dar origem ao alceno que os produziu pela reação de ozonólise oxidativa. O alceno formado é um típico aduto de Diels-Alder entre o ciclopentadieno e o crotonaldeído.
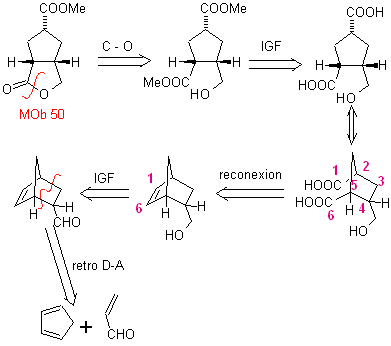
Síntese: A reação de Diels-Alder entre ciplopentadieno e o aldeído α,β-insaturado fornece o aduto alceno, para sua correspondente abertura por ozonólise oxidativa, antes de uma reação de proteção do grupo aldeído, que posteriormente é desprotegido, para ser reduzido à função álcool. Este álcool reage com o grupo éster em meio ácido para formar a lactona desejada, MOb 50
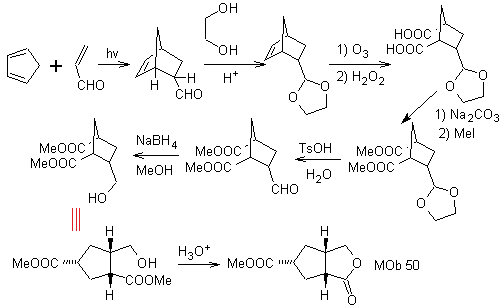
- Detalhes
- Wilbertrivera
- SÍNTESE ORGÂNICA
- Acessos: 24654
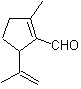
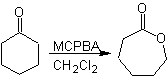
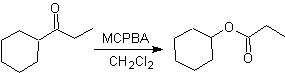
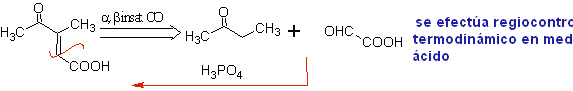
Oxidação de Baeyer-Villiger
Outra reação que pode ser associada à estratégia do A retrossíntese é a oxidação de cetonas por peroxiácidos, mais conhecida como reação de Baeyer-Villiger. Nas cetonas cíclicas, a oxidação com perácidos gera lactonas. Os grupos ligados às cetonas assimétricas têm uma capacidade migratória, o que permite, em termos literais, "inserir um átomo de oxigênio" entre o grupo carbonila e o grupo migratório, produzindo assim um éster ou uma lactona.
Deve-se levar em conta que as enonas (α, β cetonas insaturadas) não são bons substratos para a oxidação Baeyer-Villiger, pois o alceno é muito mais reativo que a cetona. Porém Existem estruturas especiais onde o alceno pode ser protegido por um substituinte próximo devido ao efeito estérico e assim direcionar o ataque do perácido para o grupo carbonila.
| … |
|
Lembre-se que a aptidão migratória dos diferentes grupos, na reação de Baeyer-Villiger, é a seguinte:
H> Ph> 3º alquil> cicloalquil> 2º alquil> 1º alquil> Me
Proponha um plano de síntese para as seguintes moléculas:
MOb 56
L-Dopa | . | MOb 57
| . | MOb 58
|
MOb 59
| MOb 60
| multidão 61
|
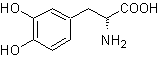
MOb 56. Análise retrossintética.
O alfa aminoácido
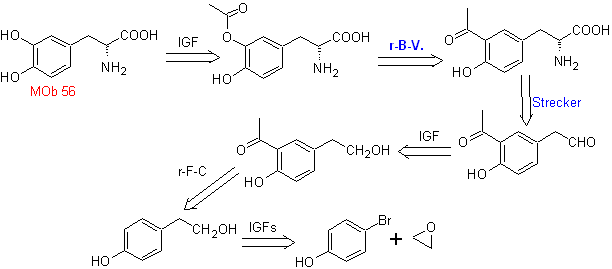
Síntese. Para Para a formação do Grignard requerido, o orto OH do benzeno é protegido. A síntese de Strecker permite a formação do aminoácido alfa, que é oxidado segundo Baeyer-Villiger com um perácido e o produto sofre hidrólise ácida do grupo éster, o que leva à formação de
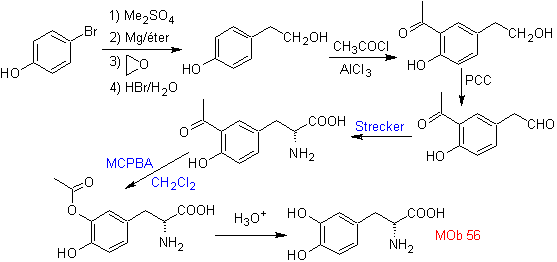
Ler mais: Oxidação de Baeyer-Villiger como estratégia na Retrossíntese
- Detalhes
- Wilbertrivera
- SÍNTESE ORGÂNICA
- Acessos: 27869
A transposição de Beckmann como estratégia em
O rearranjo de oximas em um meio ácido, denominado rearranjo de Beckman, produz uma amida ou lactama se a cetona inicial for linear ou cíclica, respectivamente.
Para melhorar o desempenho desse tipo de reação, diversos catalisadores e meios ácidos têm sido estudados. Assim, por exemplo, novos meios ácidos utilizados como catalisadores, com a finalidade indicada, são: TCT/DMF, DAST/CH 2 CL 2 , CF 3 SO 3 H, PCl 5 , HgCl 2 /MeCN e o ZnO.
TCT: triclorotriazina | …… | DAST: trifluoreto de dietilaminosulfeto |
A aptidão migratória dos grupos é a mesma da reação de Baeyer-Villiger. Proponha um projeto de síntese para cada uma das seguintes moléculas:
MOb 62 | multidão 63 | MOb 64 |
MOb 62 . Análise retrossintética.
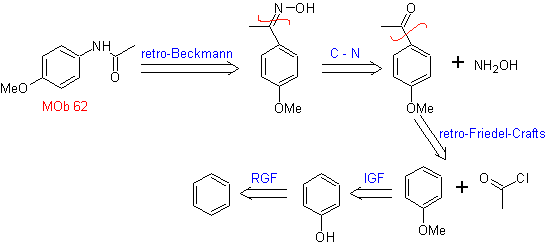
Síntese. A reação da cetona aromática intermediária com NH 2 OH e seu posterior tratamento com uma solução aquosa de ácido sulfúrico e ZnO permite a formação do amida aromática MOb 62.
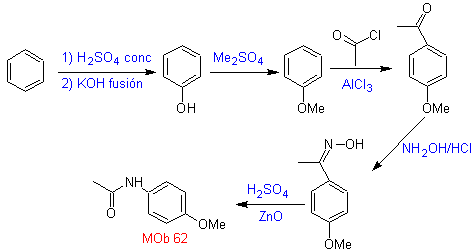
Ler mais: O rearranjo de Beckmann como estratégia na Retrossíntese
- Detalhes
- Wilbertrivera
- SÍNTESE ORGÂNICA
- Acessos: 20417
Outras estratégias de síntese que usam síntons “ilógicos”
1.
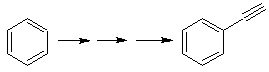
adição de ligação tripla
A estratégia de "adicionar" uma ligação tripla, entre duas funções oxigenadas na posição 1,4, permite trabalhar posteriormente com uma desconexão baseada na química dos acetiletos. Para exemplificar esta estratégia, vejamos a elaboração de um plano síntese para
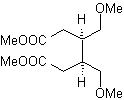
MOb. 40. Análise retrossintética . Um primeiro IGF em
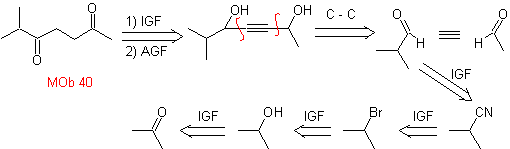
Síntese. O diacetilido ou acetileto em etapas, combina-se com moléculas de diferentes aldeídos, a molécula intermediária formada é hidrogenada e então seus álcoois são oxidados ao composto dicetônico Mob 40.
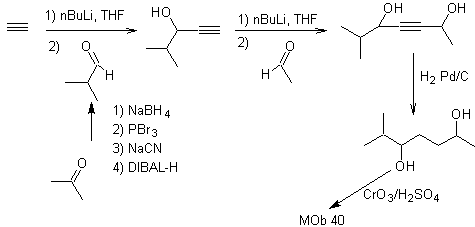
As γ-lactonas também podem ser preparadas de forma análoga, como mostrado abaixo:

2.
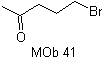
Adicionando o grupo COOR como um grupo de ativação
A adição do grupo COOR, além de ativar o ânion sínton, facilita a desconexão de uma molécula 1,4 diX.
sintetizar |
|
MOb 41. Análise retrossintética.
Ler mais: Outras estratégias de síntese que usam síntons "ilógicos"
- Detalhes
- Wilbertrivera
- SÍNTESE ORGÂNICA
- Acessos: 49729
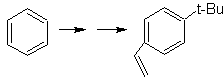
SÍNTESE DE COMPOSTOS AROMÁTICOS I
(Método da Árvore de Síntese)
Proponha um plano de síntese, usando tolueno ou xileno como materiais de partida, para as seguintes moléculas:
(MOb 12)
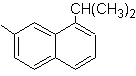
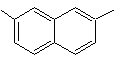
1-isopropil-7-metilnaftaleno | (MOb 13)
2,7-dimetilnaftaleno |
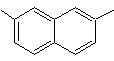
(MOb 14)
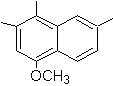
1-isopropil-6-metilnaftaleno | (MOb 15)
4-metox-1,2,7-trimetilnaftaleno |
Solução: (MOb 12).
Na estratégia que se assume, tem-se em conta que a última etapa pode responder a um processo de “aromatização”, para o qual se propõe que a molécula precursora apresente um anel não aromático, com dupla ligação.
no carbono que contém a ligação dupla e o grupo alquila.
Esta estrutura pode ser conseguida pela ação de um Grignard sobre uma carbonila e a posterior desidratação do álcool formado. A cetona é formada por acilação no composto de benzeno apropriado com anidrido succínico e seus subsequentes fechamentos de acilação intramolecular Friedel-Crafts.
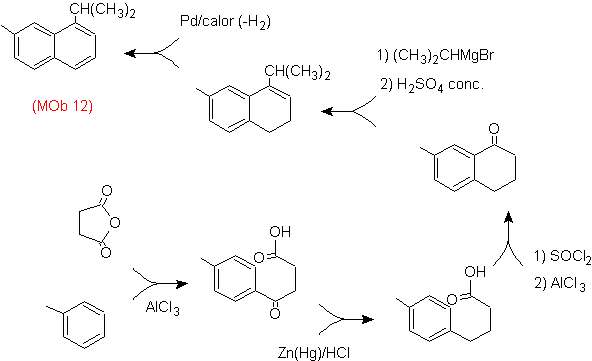
Solução (MOb 13).
Mais uma vez, a molécula precursora tem que ser "aromatizada", a estratégia mais adequada entre outras Baseia-se na combinação de acilação com anidrido succínico substituído e redução de Clemmensen.
A carbonila final é reduzida a álcool que será então desidratado com hidrogênio molecular e um catalisador chamado cromila de cobre.
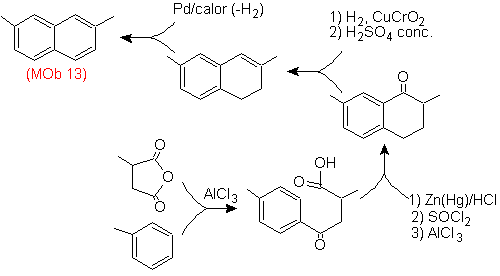
- Detalhes
- Wilbertrivera
- SÍNTESE ORGÂNICA
- Acessos: 28565
SÍNTESE DE COMPOSTOS AROMÁTICOS II
(Método da Árvore de Síntese)
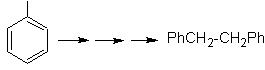
Embora um dos primeiros problemas a serem resolvidos na síntese de compostos aromáticos multissubstituídos seja o controle dos efeitos de orientação e a formação de isômeros indesejados, também é importante estudar a reatividade dos arenos, pois em algum momento da sentido da presença de grupos alifáticos no composto aromático, muitas vezes, eles apresentam características e reatividades, típicas do tipo de composto orgânico a que pertencem e as particulares que resultam da interação mútua dos grupos alifáticos e aromáticos.
Com este propósito, baseia-se, o síntese de moléculas nº 20 a 27, desta vez a partir de materiais especificados, então a questão é apresentada da seguinte forma: Quais são as reações que Justifique as seguintes transformações?
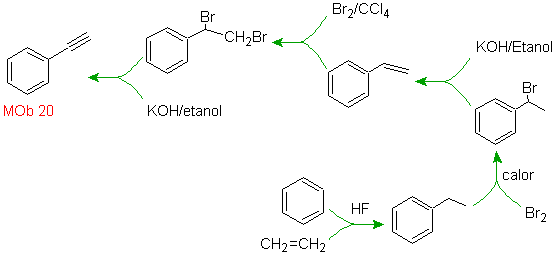
Solução Mob 20.
Sabemos que não há possibilidade do íon acetileto agir diretamente sobre o benzeno, portanto a ligação tripla é obtida a partir de um grupo alquila
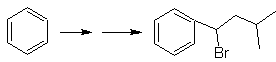
vec-dibromado, obtido pela bromação do estireno, anteriormente obtido pela desidrobromação de um haleto de benzila formado por uma bromação pelo mecanismo de radical livre em etilbenzeno
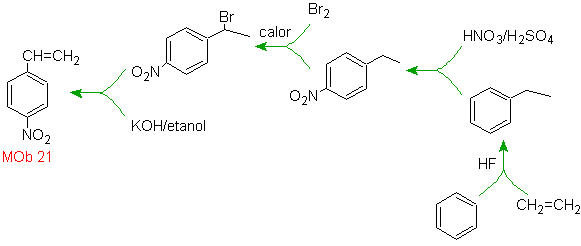
Solução Mob 21.
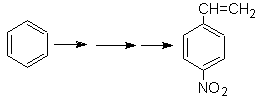
O para-nitroestireno não pode ser obtido por nitração direta do estireno, porque o grupo etenila ligado ao anel é instável sob condições de nitração.
Como tal, a molécula precursora terá um grupo fácil de desidrobrominar. Este precursor é obtido pela bromação radicalar do grupo etila ligado ao anel benzênico, que foi previamente nitrado principalmente na posição para.
- Detalhes
- Wilbertrivera
- SÍNTESE ORGÂNICA
- Acessos: 31563
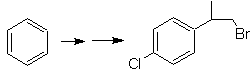
SÍNTESE DE ÁLCOOL
(Método da Árvore de Síntese)
Proponha um plano de síntese para as moléculas alvo indicadas a partir das moléculas individuais indicadas (MOb 30 -41). Para isso, utilize os reagentes e as condições de reação que julgar necessárias:
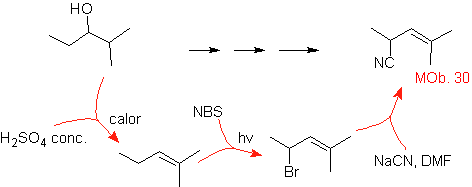
Solução MOb 30.
Estratégia: Observa-se que a molécula inicial foi desidratada e na posição alílica inicialmente não substituída, um hidrogênio foi deslocado pelo grupo ciano ou nitrila. Esta última reação só pode ocorrer se a molécula precursora for um haleto alílico, razão pela qual é proposta como precursora de
O Br é introduzido na posição desejada com o NBS e o alceno é o produto da desidratação da molécula de partida.
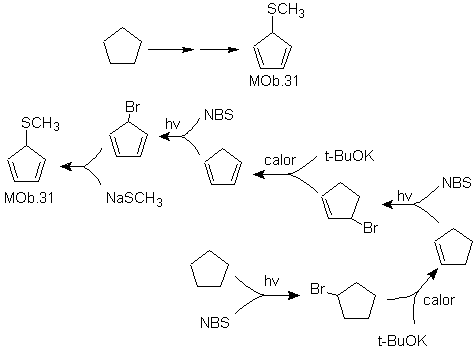
Solução MOb 31.
Estratégia : É um tio éter, a molécula precursora necessária será um haleto de 1,3-ciclopentadieno.
Este haleto é preparado pela ação do NBS sobre o cicloalceno diênico, que por sua vez é preparado pela desidrobromação da molécula precursora, que é alcançada pela ação do NBS sobre o cicloalceno formado. previamente por desidroalogenação da molécula de partida bromada por radicais
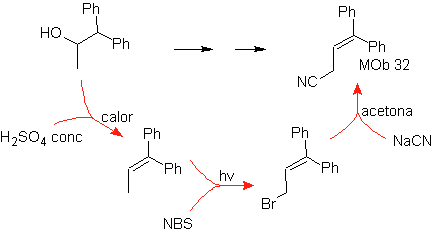
Solução Mob 32.
Estratégia : É semelhante à usada para obter
- Detalhes
- Wilbertrivera
- SÍNTESE ORGÂNICA
- Acessos: 24190
Essas reações normalmente formam anéis heterocíclicos de cinco membros, para os quais é necessária a reação entre um composto dipolar n1,3 e um alceno. A reação é uma [3-2] cicloadição. Os compostos 1,3-dipolares que tiveram mais uso para formar heterociclos pentagonais são:
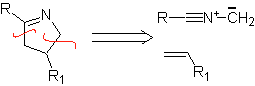 | 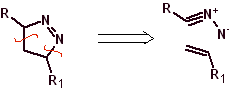 |
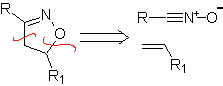 | 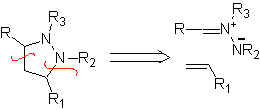 |
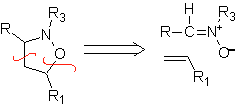 | 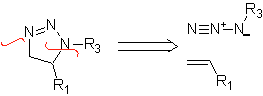 |
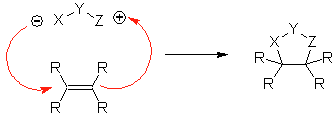
| Mb: 86
| . | Mb: 87 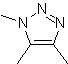 | .. | Mb: 88 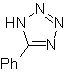 |
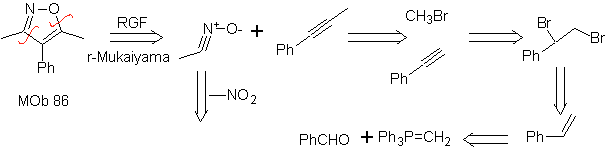
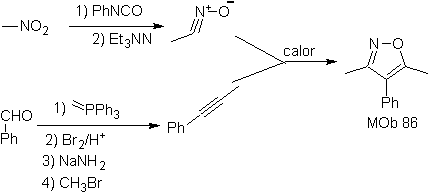
Ler mais: Síntese de heterociclos por ciclização intermolecular