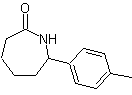
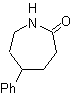
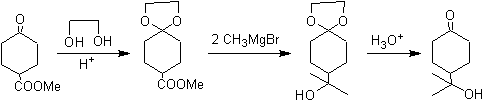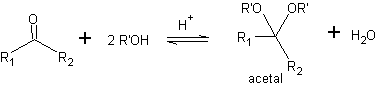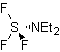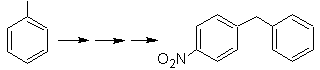SYNTHESE ORGANIQUE
- Détails
- Wilbertrivera
- SYNTHESE ORGANIQUE
- Affichages : 45797
MÉTHODES DE SYNTHÈSE ORGANIQUE
La synthèse totale d'un composé organique nécessiterait de partir à chaque fois des éléments qui le composent. Cependant, il est bien connu que des composés organiques simples tels que l'urée, le méthane, le méthanol, l'acétylène, l'acide acétique, l'éthanol peuvent être obtenus à partir des éléments, etc., des structures de plus en plus complexes peuvent être construites.
Cependant, cela n'est ni pratique ni nécessaire car il existe un grand nombre de composés organiques qui sont disponibles dans le commerce ou économiquement disponibles et ceux-ci peuvent être utilisés comme matières premières. Au sens strict, tous dérivent des éléments qui les composent ou peuvent en dériver, ainsi toute synthèse entreprise à partir de ces matières premières sera « formellement » une synthèse totale.
Les méthodologies de synthèse pour faire face à une synthèse réussie ont changé avec le temps et le développement de la chimie elle-même en tant que science, d'où les éléments suivants :
- Méthodologie de « l'association directe »
- Méthodologie de « l'approche intermédiaire »
- Méthodologie de "l'analyse logique"
- Détails
- Wilbertrivera
- SYNTHESE ORGANIQUE
- Affichages : 30383
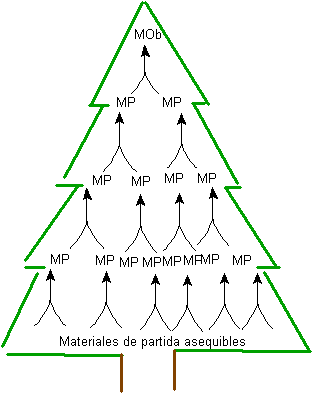
L'élaboration d'un « arbre de synthèse » basé sur la génération de molécules intermédiaires ou précurseurs, pas à pas dans le sens antithétique (rétrosynthèse), c'est-à-dire à partir de la molécule objectif, constitue une méthode qui peut être mieux comprise en considérant les principes généraux suivants dudit processus.
1. Commencez par la structure finale (MOb). A partir de la structure finale, la molécule cible, travailler à rebours (rétrosynthèse) jusqu'à l'obtention de matières premières facilement accessibles. Si la matière première de départ est précisée dans le problème de synthèse, cela ne fait que limiter le nombre de voies de synthèse possibles à aborder.
2. Caractérisation de la molécule cible (MOb ). Lors de l'examen de la structure de la molécule cible, il est nécessaire de répondre aux questions suivantes :
pour. De quel type de composé s'agit-il ?
b. Quel(s) groupe(s) fonctionnel(s) contient-il ?
c. Quelle est la nature du squelette carboné ?
d. La molécule possède-t-elle une chaîne alkyle normale ou ramifiée ?
et. Contient-il des cycles et sont-ils cycloalkyles ou aromatiques ?
F. Le MOb a-t-il une symétrie réelle ou potentielle ?
3. Le groupe fonctionnel . À cet égard, il sera également bon de répondre aux questions suivantes :
pour. La réactivité, la sensibilité et l'instabilité des groupes fonctionnels que possède le MOb sont-elles connues ?
b. Quelles méthodes générales sont disponibles pour sa préparation?
c. Lequel d'entre eux est applicable au groupe fonctionnel spécifique de la molécule problématique ?
4. Aspects stéréochimiques . Il sera analysé dans le MOb, de préférence :
pour. centres de chiralité
b. Façonnage et configuration des anneaux
c. Effets de proximité entre groupes
5. Le squelette carbonaté . Le principal problème dans la plupart des synthèses organiques est la construction du squelette carboné. L'échange de groupes fonctionnels (IGF) est souvent simple à faire, comme la cétone en alcool, l'aldéhyde en acide ou l'alcool en bromure. Les questions posées sur la construction des liens CC sont en lien avec celles qui ont déjà été posées sur le groupe fonctionnel.
pour. Certaines des méthodes disponibles pour former des groupes fonctionnels sont-elles applicables pour générer des liens CC ? Si oui.
b. La méthode est-elle compatible avec le squelette carboné spécifique de la molécule cible ? Si ce n'est pas le cas.
c. Existe-t-il une procédure pour former une chaîne carbonée produisant une fonction convertible en celle requise ?
6. Molécules précurseurs (MP)
L'analyse de la structure de la molécule problématique et la prise en compte des questions posées dans les étapes 1) à 5), donneront lieu à deux types possibles de molécules précurseurs. L'un d'eux contient un groupement fonctionnel équivalent à celui de la structure finale.
L'autre est un composé avec moins d'atomes de carbone que la molécule cible. Lorsque ces derniers sont réunis, la chaîne carbonée finale et la fonctionnalité requise sont atteintes.
La génération de l'un quelconque de ces types de molécules précurseurs devrait entraîner une simplification du problème.
En général, si un chemin projeté conduit à des précurseurs plus difficiles à synthétiser que le problème lui-même (cible), un autre chemin doit être recherché.
Fig. 1. ARBRE DE SYNTHÈSE
La génération de molécules précurseurs, jusqu'à atteignant les matériaux de départ, génère une série de structures, qui forment ensemble une sorte d'arbre, fig.1. C'est de là que vient le nom de la méthode de synthèse.
Lire la suite : Principes généraux de la méthode de l'arbre de synthèse
- Détails
- Wilbertrivera
- SYNTHESE ORGANIQUE
- Affichages : 36374
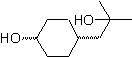
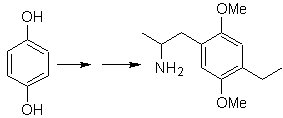
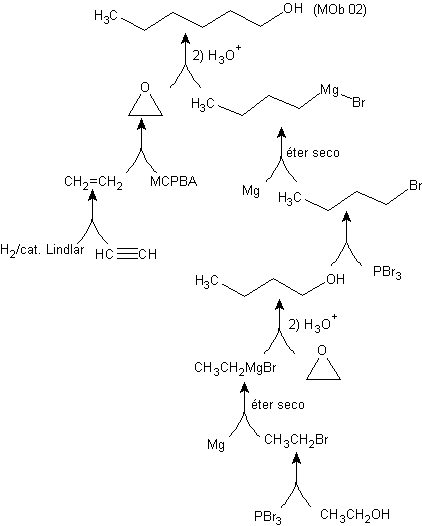
Synthèse de n-Hexanol ( MOb 02)
Solution : le n-Hexanol (MOb 02) est un alcool primaire, dont la chaîne carbonée n'a pas de ramifications. La stratégie se réduit donc à rechercher des réactions permettant à la chaîne de croître dans un bon nombre d'atomes de carbone. Il n'est pas conseillé que la croissance de la chaîne se fasse une par une, car ce chemin conduirait à un plan de synthèse avec de nombreuses étapes, par conséquent un faible rendement.
Ainsi, l'ouverture de cycles époxydes par un composé de Grignard peut suffire à cet effet ; car il peut également être combiné avec la synthèse acétylénique (utilisation de dérivés de l'acétylure de sodium et saturation ultérieure de la triple liaison).
L'époxyde nécessaire pour se combiner avec le Grignard est préparé à partir d'un alcène et d'un acide peracide. Ainsi, le présent plan de synthèse est déduit, où les matières premières peuvent être l'acétylène et l'éthanol.
Lire la suite : Problèmes de synthèse, résolus par la méthode Synthesis Tree
- Détails
- Wilbertrivera
- SYNTHESE ORGANIQUE
- Affichages : 43453
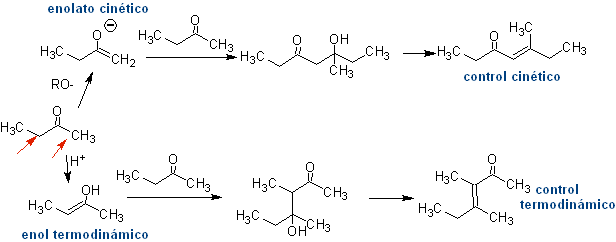
Formation d'énols et d'énolates
Le carbone alpha des composés contenant le groupe carbonyle (aldéhydes, cétones, esters, dicétones, diesters, nitrates, nitriles, etc.), est au centre de nombreuses réactions de formation de liaisons CC. En raison de l'acidité des H a , ils subissent une -déprotonation en présence d'une base appropriée, avec pour conséquence la formation d'un carbanion. La charge négative résultante sur C a à C = O est stabilisée en résonance par le même groupe carbonyle.
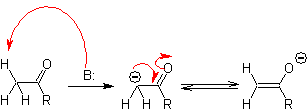
La sélection de la base, pour la formation d'énolates, est soumise au fait que le pKa de l'acide conjugué de la base doit être supérieur d'au moins trois unités au pKa du composé carbonylé qui a des H acides .
|
|
pKa = 20 |
MeO- pKa = 15 |
Formation d'énolate défavorable |
|
|
pKa = 10 |
tBuO- _ pKa = 19 |
Formation d'énolates très favorable |
Formation d'énolates :
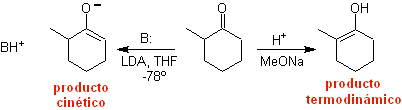
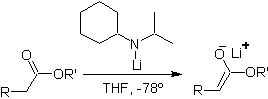
¨ L'énolate cinétique
|
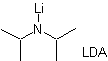
Cela se produit parce que le substrat a H α , facilement accessible pour la déprotonation à travers une base typique telle que LDA (pKa environ 30) Le LDA (diisopropylamide de lithium) est une base forte, non nucléophile et à encombrement stérique. |
|
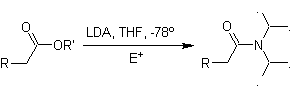
¨ Enolates d'esters :
Les esters sont susceptibles d'une réaction de substitution pour la base, LDA peut être problématique, c'est pourquoi la base non nucléophile (lithium isopropylcyclohexyl amide) est utilisée avec des esters.
¨ Énolate thermodynamique :
Une déprotonation réversible peut conduire à des énolates plus stables, ce qui se produit lorsque le C = C plus substitué de la forme énol est obtenu.
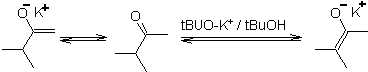
Les conditions typiques pour former des énolates thermodynamiques sont : RO-M+ dans ROH comme solvant protique (pKa de ROH = 15 à 18).
Les énolates cinétiques et thermodynamiques peuvent être piégés, isolés, séparés et purifiés pour obtenir des énolates régiochimiquement purs. Ceci peut être accompli par la formation d'acétates d'éther d'énol et de silylène.
- Détails
- Wilbertrivera
- SYNTHESE ORGANIQUE
- Affichages : 46669
Réactions des énols et des énolates
Réactions d'aldol et réactions dites de condensation de composés carbonylés et autres de ce type, qui peuvent former des structures énols et énolates, participent à un grand nombre de réactions importantes qui nous permettent de comprendre l'existence d'un nombre immense de molécules résultant de l'interaction d'énols ou d'énolates avec une série de groupes électrophiles.
L'étude de ce type de réaction a permis de vérifier et d'établir l'existence de deux mécanismes réactionnels par lesquels elles se produisent, comme expliqué ci-dessous :
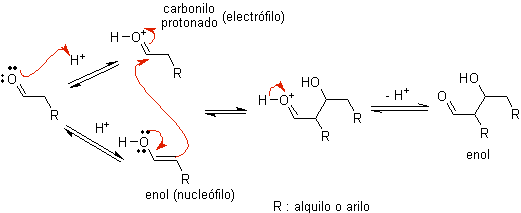
POUR) Lorsqu'un acide est utilisé comme catalyseur, le composé carbonyle est initialement protoné puis tautomérisé en sa forme énol , qui est un nucléophile sur le carbone alpha du groupe carbonyle. Le même milieu acide suffit à activer le groupe carbonyle d'une autre molécule, la rendant hautement électrophile, ce qui génère des conditions optimales pour produire un composé carbonyle insaturé.
La réaction se déroule normalement jusqu'à la déshydratation de l'énol formé, catalysée par le même acide de la réaction.
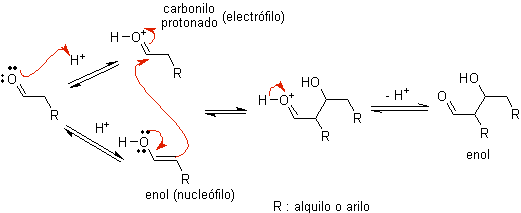
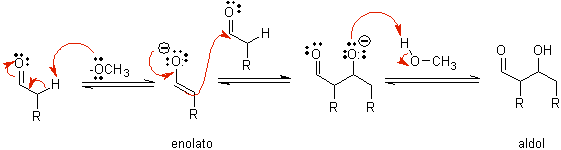
B) Lorsque le catalyseur est une base, telle qu'un alcoxyde, la réaction de type aldol se déroule via l'attaque nucléophile de l'énolate stabilisé par résonance sur le groupe carbonyle d'une autre molécule.
Par déshydratation de l'aldol, catalysée par la base, le produit final déshydraté est formé.
Comme dans le cas précédent, la déshydratation catalysée par une base (parfois écrite en une seule étape), permet de contrôler la réaction et de produire un produit final déshydraté. Dans certains cas, la formation d'énolates est irréversible.
Comme on le voit seule une quantité catalytique de base est nécessaire dans certains cas, la procédure la plus courante consiste à utiliser une quantité estequiométrica de base forte telle que LDA ou NaHMDS . Dans ce cas, la formation d'énolate est irréversible et le produit aldol n'est pas formé tant que l'alcoolate métallique du produit aldol n'est pas protoné dans une étape ultérieure.
- Détails
- Wilbertrivera
- SYNTHESE ORGANIQUE
- Affichages : 36719
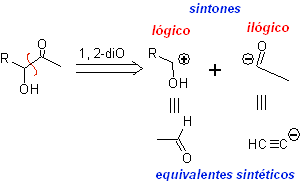
La synthèse organique, cœur de la chimie organique , est une activité essentiellement heuristique , c'est-à-dire qu'il s'agit d'un processus où les activités créatives hautement prédictives de la pensée logique et des procédures empiriques, riches en élaboration artistique, se confondent, faisant du chimiste organique un véritable innovateur.
Comme toute méthode, la « méthode de déconnexion ou synthon » a sa structure, sa symbologie et son langage propres, qui doivent dans un premier temps être assimilés et compris par ceux qui souhaitent utiliser cet outil de synthèse.
La méthode de synthèse des déconnexions ou synthon , comprend Deux phases ;
![]() Phase d'analyse rétrosynthétique . Il montre toutes les transformations qui seront effectuées dans le processus de simplification de la structure de
Phase d'analyse rétrosynthétique . Il montre toutes les transformations qui seront effectuées dans le processus de simplification de la structure de
![]() Phase de synthèse . Où ce qui est "pensé", basé sur des critères de rationalité mécaniste et de réactivité des composés organiques, se matérialise dans une voie de synthèse, qui sera écrite, telle qu'elle est censée se produire dans le laboratoire de chimie. C'est là que l'expérience émerge et manifeste « l' art de faire ou inventer » du chimiste, c'est-à-dire
Phase de synthèse . Où ce qui est "pensé", basé sur des critères de rationalité mécaniste et de réactivité des composés organiques, se matérialise dans une voie de synthèse, qui sera écrite, telle qu'elle est censée se produire dans le laboratoire de chimie. C'est là que l'expérience émerge et manifeste « l' art de faire ou inventer » du chimiste, c'est-à-dire
Les les termes, définitions ou opérations de synthèse, récurrents dans cette méthode, sont les suivants :
Molécule cible (MOb) .
C'est le nom donné à toute molécule qui doit être synthétisée ou préparée à partir de matériaux simples et abordables, qui dans un problème peuvent être préalablement définis ou ajustés aux options que le chimiste génère dans son plan ou sa conception de synthèse.
métamorphose . ( ![]() ).
).
La flèche spéciale de rétrosynthèse unidirectionnelle doit être comprise comme une représentation symbolique de l'expression « est préparé à partir de » et représente également une sorte de transformation dans la structure de
Les types de transformation dont il est question sont en réalité des opérations rétrosynthétiques telles que : Déconnexions, Reconnexions, Réarrangements, Interconversion de Groupes Fonctionnels (IGF), Ajout de Groupes Fonctionnels (AGF), Suppression de Groupes Fonctionnels (SGF), etc.
Coupure.
C'est une opération de rétrosynthèse qui représente la rupture imaginaire des liaisons chimiques qui se seraient formées dans la molécule cible, à partir des synthons ou plus précisément de leurs équivalents synthétiques (molécules précurseurs), postulés.
Il peut être compris comme l'inverse d'une réaction chimique, il est représenté par une flèche (très différente de celle d'une réaction chimique ou des conditions d'équilibre) et une ligne ondulée barrée sur la liaison qui sera "déconnectée".
Il est même possible de placer la déconnexion proposée sur la flèche : CC, CS. CX, CO, CN. etc. Expressions qui nous lient au type de réaction qui sera utilisé, dans la formation de
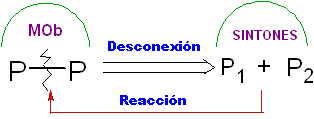
Dans d'autres cas, le modèle de déconnexion utilisé peut s'écrire, par exemple, il est courant de trouver : 1, 3-diO, 1,4 –diCO, 1,5-diCO ou α, β -insatCO . Etc.
Par conséquent, dans une molécule dioxygénée, on peut s'attendre à ce que les déconnexions suivantes se produisent :
![]() déconnexions hétérolytiques,
déconnexions hétérolytiques,
![]() Déconnexions homolytiques ou radicales
Déconnexions homolytiques ou radicales
![]() Déconnexions électrocycliques
Déconnexions électrocycliques
![]() Réorganiser les déconnexions
Réorganiser les déconnexions
- Détails
- Wilbertrivera
- SYNTHESE ORGANIQUE
- Affichages : 27843
DÉCONNEXIONS DE COMPOSÉS DE 1,3-DIOXYGÈNE
Les composés organiques oxygénés sont les plus abondants dans la nature et particulièrement les dioxygénés, c'est pourquoi de nombreux chercheurs en chimie ont modélisé la déconnexion rétrosynthétique de ces molécules, aspect qui sera étudié dans les paragraphes suivants.
Pour commencer, les modèles de déconnexion des molécules dioxygénées ont été divisés en deux grands groupes, basés sur la nature des synthons qui sont générés avec l'application d'une opération de synthèse de base appelée " DÉCONNEXION " à la molécule à synthétiser et que généralement elle est appelée molécule cible (MOb) .
Ces grands groupes sont :
![]() Modèles de déconnexion « logiques », et
Modèles de déconnexion « logiques », et
![]() Modèles de déconnexion « anormaux » ou « illogiques »
Modèles de déconnexion « anormaux » ou « illogiques »
Les modèles de déconnexion dits « logiques » sont ceux qui, en appliquant une « déconnexion » d'une ou plusieurs liaisons chimiques dans
Les composés pouvant être classés en 1,3-dioxygène et 1,5-dioxygène, lorsqu'ils sont soumis à une rétrosynthèse, forment généralement des synthons considérés comme "logiques". En revanche, les molécules organiques apparentées aux 1,2-dioxygénés, 1,4-dioxygénés et 1,6-dioxygénés, génèrent des synthons
considéré comme "illogique"
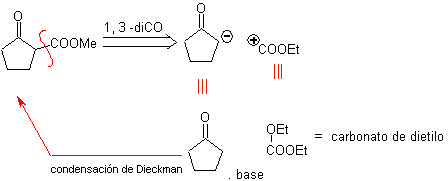
Modèle de coupure 1,3-dioxygène
![]() Composés β-dicarbonyle
Composés β-dicarbonyle
Les composés 1,3-dicarbonyles sont obtenus avec de bons rendements par des réactions de condensation de type Claisen, qui impliquent la réaction entre des esters et des composés à hydrogènes actifs, tels que : esters, cétones, aldéhydes, nitriles, dérivés nitrés et certains hydrocarbures en présence de réactifs alcalins.
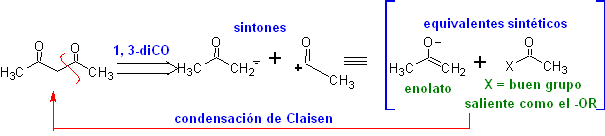
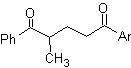
Les β-dicétones et β-cétoaldéhydes sont obtenus par la condensation croisée de Claisen, en utilisant une cétone et un ester appropriés. Dans la condensation croisée de Claisen des cétones et des esters, on obtient de bons rendements car les cétones sont notablement plus acides que les esters, donc, en milieu basique, la cétone est plus déprotonée que l'ester.
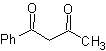
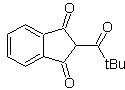
Exemples : Proposer un design de synthèse à partir de matériaux simples, pour les molécules suivantes :
Mob 16
| foule 17
| Mob 18
|
Solution:
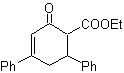
MOb 16 . Apparemment, les deux alternatives de déconnexion (a) et (b), montrées dans
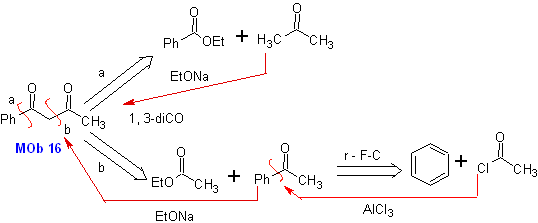
Cependant, l'alternative (b) s'avère la plus adaptée, car, dans le milieu réactionnel basique, le carbanion formé PhCOCH 2 - serait mieux stabilisé, du fait des effets de résonance et inductifs.
- Détails
- Wilbertrivera
- SYNTHESE ORGANIQUE
- Affichages : 25584
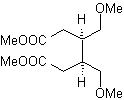
Les composés 1,5-dioxygénés sont généralement le résultat de réactions d'addition conjuguées de nucléophiles à partir de composés carbonylés, avec des H α acides (énols, énolates, énamines, etc.), ainsi que des nitriles et des nitrates, sur des substrats alpha bêta insaturés en ce qui concerne à des groupes carbonyle et similaires, connus sous le nom de réaction de Michael, avec des options complémentaires étant la réaction Nef et la réaction d'annulation (annulation) de Robinson.
Déconnecter modèle 1, 5 dioxygène (1,5-diO)
Le modèle de déconnexion 1,5-diO peut être appliqué, après la fonctionnalisation nécessaire, à des composés tels que : 1,5-dihydroxyles, 1,5-hydroxyaldéhydes, 1,5-hydroxycétones, 1,5-hydroxyesters, 1,5- cétoaldéhydes, 1,5-dicétones, 1,5-cétoesters, 1,5-dialdéhydes, etc.
Les possibilités augmentent si l'on prend également en compte les dérivés nitrés et les nitriles qui peuvent former des carbanions très réactifs en milieu basique capables de s'additionner à des composés carbonylés α ,β-insaturés pour obtenir des produits de type 1,5-diO.
L' analyse fondamentale de la déconnexion des composés 1,5-diO est la suivante :
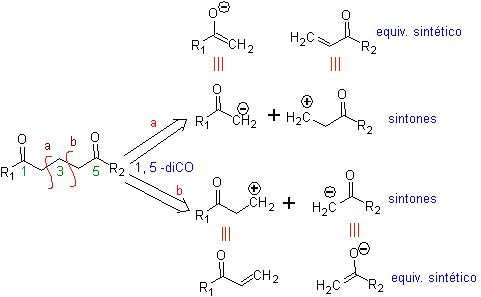
Le choix de la déconnexion (a) ou (b), autour de C3, dépendra de la nature des groupements R1 et R2, qui pourra conférer une stabilité plus ou moins grande au synthon ou équivalent synthétique nécessaire à la formation de
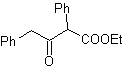
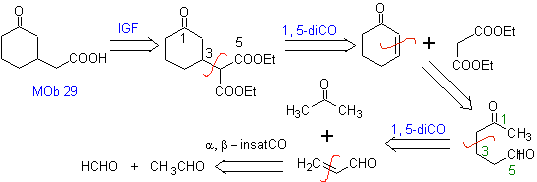
Proposer un design de synthèse pour MOb 29, 30 et
|
Mob 29
|
|
Mob 30
|
|
Mob 31
|
Solution:
MOb 29 . Analyse rétrosynthétique : Le carbanion nécessaire à ajouter au composé a , b -insaturé CO Il peut être obtenu à partir de malonate de diéthyle en milieu basique. Ce qui forcera par la suite une décarboxylation, pour atteindre
- Détails
- Wilbertrivera
- SYNTHESE ORGANIQUE
- Affichages : 62534
Dans la conception de synthèse d'une molécule à plusieurs groupes fonctionnels, il est très courant qu'un réactif qui produit une transformation sur un groupe fonctionnel affecte également un autre groupe présent dans une autre partie de la molécule. Dans les cas où une chimiosélectivité adéquate ne peut pas être obtenue sur le groupe fonctionnel à transformer, le groupe qui doit rester inchangé est
protégé en le convertissant temporairement en fonctionnalité inerte aux conditions de réaction.
L'opération de protection nécessite la procédure suivante :
· Protéger le(s) groupe(s) fonctionnel(s) le(s) plus réactif(s) de manière sélective et dans des conditions douces.
· Effectuer la réaction sur le groupe fonctionnel requis sans affecter le groupe protégé
· Groupe fonctionnel non protégé, soumis à la protection
La l'action de protection doit satisfaire aux exigences de base suivantes :
· La réaction doit bien fonctionner et être chimiosélective.
· Le nouveau groupe fonctionnel doit être stable dans les conditions réactionnelles du groupe qui va réagir.
· La fonctionnalité introduite ne doit pas ajouter de centres chiraux à la molécule pouvant générer des diastéromères
· Le groupe fonctionnel d'origine doit pouvoir être régénéré avec un bon rendement et sans affecter le reste de la molécule.
L'utilisation de protecteurs doit être réduite au strict minimum et leur choix doit être tel qu'ils n'aient pas besoin d'être remplacés tout au long de la synthèse, car les étapes d'introduction et d'élimination (déprotection) ajoutent du coût et du travail à la synthèse et diminuent le rendement. Exemple.
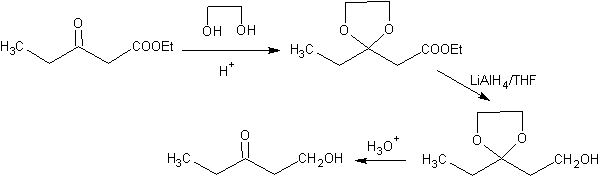
Le groupe cétonique de la molécule a été protégé en le transformant en un cétal cyclique, avec un éthanediol en milieu légèrement acide, ensuite cette molécule a été mise à réagir avec deux moles de bromure de phénylmagnésium, qui agit sur le groupe ester, pour le transformer en un alcool tertiaire, avec deux substituants méthyle apportés par le Grignard. Enfin, le cétal cyclique est hydrolysé pour régénérer la cétone.
En pratique, il n'y a pas de groupe de protection parfait pour chaque fonctionnalité, mais on peut affirmer qu'il existe une grande batterie de protecteurs possibles, chacun remplissant les conditions ci-dessus dans certaines circonstances. Une courte liste de protection des groupes les plus courants est incluse dans les sections suivantes :
PROTECTION CONTRE LES ALDÉHYDES ET CÉTONES
Une façon de protéger les cétones et les aldéhydes est leur conversion en acétals. Les acétals peuvent être déprotégés dans des conditions douces par des réactions d'hydrolyse acide.
Dans la réduction d'un cétoester en cétoalcool. La protection de la cétone sous la forme d'un acétal est très pratique car l'acétal résiste aux conditions réductrices dans lesquelles il sera utilisé dans la conversion du groupe ester en groupe hydroxyle.
Le schéma suivant montre la séquence de synthèse complète qui permet de réaliser la réduction de l'ester sans affecter la cétone :
Dans la première étape, la cétone est convertie en acétal cyclique par réaction avec l'éthylène glycol en présence d'un catalyseur acide. Dans la deuxième étape, l'ester est réduit avec LiAlH 4 . Ce réactif n'attaque pas l'acétal. Enfin, dans la troisième étape, l'alcool-acétal est traité en milieu aqueux acide. Dans ces conditions, l'acétal est hydrolysé, régénérant le groupe carbonyle cétonique. Chacune des trois étapes est chimiosélective puisque dans chacune d'elles la réaction préférée d'un groupe fonctionnel est réalisée. en présence d'un autre.
Lire la suite : Protection des groupes fonctionnels en synthèse organique
- Détails
- Wilbertrivera
- SYNTHESE ORGANIQUE
- Affichages : 29084
Le contrôle en synthèse organique est l'une des tâches les plus importantes pour réaliser la transformation requise ou planifiée. et/ou pour éviter la formation de ces sous-produits qui entravent considérablement le développement optimal de la synthèse organique en question. De même, d'un point de vue plus général, le contrôle peut également inclure ou couvrir les aspects de symétrie et de sélectivité.
Ensuite, le contrôle doit être compris comme une série d'opérations de synthèse qui permettent au chimiste de former le squelette carboné avec la fonctionnalité voulue ou de "placer" un groupe ou un atome à la place ou à la position requise.
Par conséquent, ces opérations peuvent être d'une gamme variée de routines avec une intention reflétée par le chimiste et qui exigent certaines capacités cognitives et compétences similaires à celles artistiques, pour la construction (synthèse) de molécules organiques.
Par conséquent, dans les réactions de condensation, comme dans d'autres, les opérations de contrôle peuvent être incluses dans l'une des catégories suivantes.
![]() Réactions concurrentes (auto-condensation et/ou condensation croisée)
Réactions concurrentes (auto-condensation et/ou condensation croisée)
![]() Activation – désactivation
Activation – désactivation
![]() Sélectivité et spécificité
Sélectivité et spécificité
![]() Protection-déprotection
Protection-déprotection
Dans les réactions de condensation des composés carbonylés, il est essentiel d'établir à l'avance l'ordre des événements pour minimiser ou, si nécessaire, supprimer les possibilités d'auto-condensation et l'apparition de condensation croisée, qui sont malheureusement une menace évidente dans ces réactions. .
auto condensation
Tous les composés carbonyle qui ont un ou plusieurs hydrogènes alpha, sur les carbones adjacents au groupe carbonyle, courent le risque de subir une réaction d'auto-condensation si la rigueur correspondante n'est pas suivie.
Ainsi, par exemple, si une base non hydroxylée telle que EtONa est ajoutée à une 2-butanone, il se formera un énolate qui pourra éventuellement se combiner avec une autre molécule de la même cétone. De même, si H+ est ajouté, une auto-condensation peut également se produire, comme on peut le voir dans le schéma suivant : cela peut être minimisé en ajoutant à la même vitesse, à partir de dispositifs d'alimentation séparés, la base ou l'acide au composé qui fournira l'énol ou l'énolate et le composé carbonyle qui sera attaqué sur le carbone carbonyle . Un ballon tricol et une agitation magnétique peuvent être utilisés.
v\:* {comportement:url(#default#VML);} o\:* {comportement:url(#default#VML);} w\:* {comportement:url(#default#VML);} .shape {behavior:url(#default#VML);} Normal 0 21 faux faux faux MicrosoftInternetExplorer4
/* Définitions de style */ table.MsoNormalTable { mso-style-name:"Normal Table" ; mso-tstyle-rowband-size:0 ; mso-tstyle-colband-size:0 ; mso-style-noshow : oui ; mso-style-parent : "" ; mso-rembourrage-alt:0cm 5.4pt 0cm 5.4pt; mso-pour-marge : 0 cm ; mso-pour-marge-bas :.0001pt ; mso-pagination:veuve-orpheline; taille de police : 10,0 pt ; font-family:"Times New Roman" ; mso-ansi-language:#0400 ; mso-fareast-language:#0400; mso-bidi-language:#0400;}
condensation croisée
Idéalement, dans les réactions de condensation de composés carbonylés, l'une des molécules réactives devrait s'énoliser rapidement, tandis que l'autre devrait de préférence ne pas avoir de Hα. , pour s'assurer qu'aucun autre sous-produit ne se forme
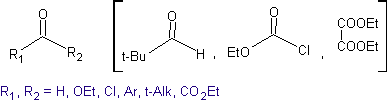
La rétrosynthèse qui est analysée ci-dessous est un bon exemple de ce qui a été indiqué précédemment.
Lire la suite : Contrôle de la condensation des composés carbonylés
- Détails
- Wilbertrivera
- SYNTHESE ORGANIQUE
- Affichages : 25880
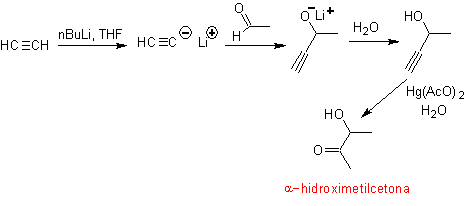
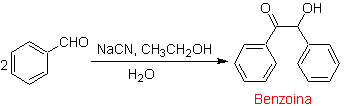
Déconnexion des composés 1,2-dioxygénés
1.- Composés a
-hydroxycarbonyle
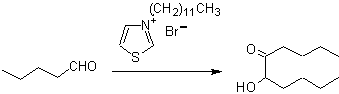
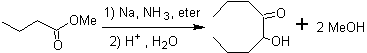

- Détails
- Wilbertrivera
- SYNTHESE ORGANIQUE
- Affichages : 26597
COUPURE DE COMPOSÉS DE 1,4-DIOXYGÈNE
Un autre groupe de composés de grande importance en synthèse chimique est constitué de molécules dioxygénées qui se retrouvent dans un rapport de distance de 1,4. Ces composés, lorsqu'ils sont soumis à une analyse de déconnexion rétrosynthétique, génèrent des synthons, dont l'un, l'électrophile ou le nucléophile, peut être considéré comme "anormal" ou "illogique", car la charge attribuée à l'un des atomes ne s'explique pas par termes de son électronégativité intrinsèque ou induite.
1. Composés 1,4-dioxygène (1,4-diO)
Dans ce type de composés, la déconnexion conduit également à un synthon logique et à un autre synthon illogique (non naturel), qui peut être un nucléophile ou un électrophile, dont l'équivalent synthétique doit encore être adéquatement retravaillé, afin d'être utilisé dans la réaction chimie.
1. 1. Composés 1,4-dicarbonyle
1.1.1. Composés de 1,4-dicétone
Les alternatives de déconnexion de ce type de composés ou molécules à synthétiser (MOb), peuvent conduire aux options suivantes :
pour. Un synthon anionique logique et un synthon cationique illogique
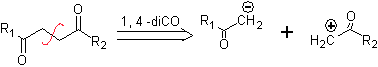
L'équivalent synthétique de l'anion est l'ion énolate ou l'énol lui-même du composé carbonyle. Au lieu de cela, l'équivalent synthétique du carbocation est l'alpha halocarbonyle. (Umpoloung)
b. Un synthon cationique logique et un synthon anionique illogique
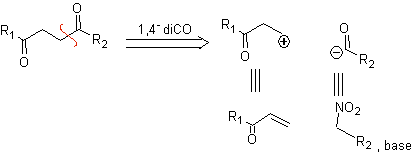
L'équivalent synthétique du synthon cationique logique est le composé carbonyle α,β-insaturé. Un équivalent synthétique approprié pour l'anion synthon peut être un anion nitroalcane. Le groupement –NO 2 des alcanes peut être transformé en C=O, par la réaction de Nef, ou par les variantes de la réaction de McMurry, où par action de TiCl 3, le nitroalcane est transformé en une imine, qui est alors It est hydrolysé en milieu acide en le composé carbonylé respectif.
1.1.2. Composés 1,4-cétoester
Les γ-cétoesters, les 1,4-diesters et les 1,4-diacides peuvent être déconnectés d'un synthon cationique naturel, dont l'équivalent synthétique est un composé carbonylé α,β-insaturé, et du non-naturel («illogique» ) anion synthon.(-) COOR, dont l'équivalent synthétique est l'ion cyanure.
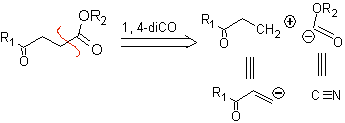
Exemples : Proposer un design de synthèse, à partir de matériaux simples et abordables, pour chacune des molécules suivantes :
|
Mob 35
|
|
Mob 36
|
|
|
|
|
|
Mob 37
|
|
Mob 38
|
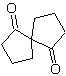
MOb 35 (a). Analyse rétrosynthétique . La molécule peut être déconnectée selon le modèle 1,4-diCO. Le précurseur généré cyclopentanone doit être préalablement activé pour que son Cα soit plus nucléophile, puis être utilisé dans la réaction avec l'α.bromoacétone.
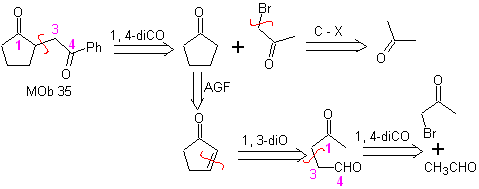 synthèse . La nucléophilie de la cyclopentanone est contrôlée et garantie, à l'aide de LDA, pour arriver à
synthèse . La nucléophilie de la cyclopentanone est contrôlée et garantie, à l'aide de LDA, pour arriver à
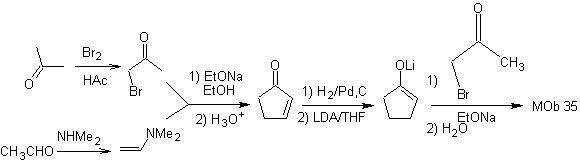
- Détails
- Wilbertrivera
- SYNTHESE ORGANIQUE
- Affichages : 21590
DÉCONNEXION DES COMPOSÉS DE 1,6-DIOXYGÈNE
Les composés 1,6-difonctionnalisés utilisent de préférence la stratégie de reconnexion pour leur synthèse respective ; Cette stratégie peut très bien être combinée avec la réaction de Diels-Alder, qui produit généralement des adduits oléfiniques à six chaînons, ou la réduction de Birch de cycles benzéniques, qui génère également des produits oléfiniques à six chaînons.
1. Composés 1,6-dioxygénés
La réaction qui génère des composés dicarbonylés, de différentes combinaisons possibles : dicétones, cétoacides, cétoaldéhydes, diacides, etc. et à différentes distances les uns des autres, est sans doute la réaction de ozonolyse des composés oléfiniques.
En fonction de la structure du substrat et des conditions de réaction sur l'intermédiaire ozonide formé, une énorme diversité de composés sera obtenue à la suite du clivage de la double liaison oléfinique. Parmi ceux-ci, ceux qui sont dans un rapport 1, 6 - dioxygéné présentent un intérêt particulier, comme on peut le déduire de l'opération de « reconnexion » synthétique suivante :
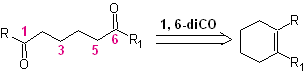
La meilleure façon de comprendre le fonctionnement de cette « opération de reconnexion synthétique » est sera réalisé grâce à la solution de la synthèse des molécules organiques suivantes :
|
Mob 50
|
|
Mob 51
|
|
Mob 52
|
|
|
|
|
|
|
|
Mob 53
|
|
Mob 54
|
|
Mob 55
|
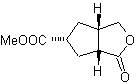
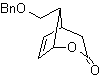
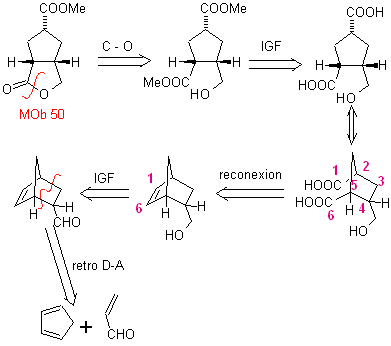
MOb 50 . Analyse rétrosynthétique : Elle est en premier lieu déconnectée par la fonction lactone de la molécule. Sur la molécule précurseur générée, à son tour, on peut affirmer que sa formation peut avoir eu lieu à partir de l'acide diacarboxylique en position 1-6. Qui se reconnectent pour donner naissance à l'alcène qui les a produits par réaction d'ozonolyse oxydative. L'alcène formé est un adduit typique de Diels-Alder entre le cyclopentadiène et le crotonaldéhyde.
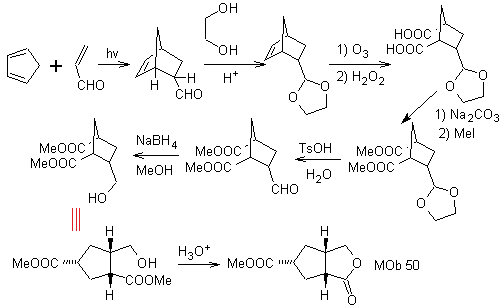
Synthèse : La réaction de Diels-Alder entre cyclopentadiène et l'aldéhyde α,β-insaturé fournit l'adduit alcène, pour son ouverture correspondante par ozonolyse oxydante, préalablement à une réaction de protection du groupement aldéhyde, qui est ensuite déprotégé, à réduire en fonction alcool. Cet alcool réagit avec le groupement ester en milieu acide pour former la lactone souhaitée, MOb 50
- Détails
- Wilbertrivera
- SYNTHESE ORGANIQUE
- Affichages : 25628
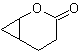
Oxydation Baeyer – Villiger
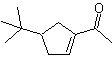
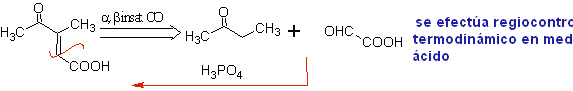
Une autre réaction qui peut être associée à la stratégie du La rétrosynthèse est l'oxydation des cétones par les peroxyacides, mieux connue sous le nom de réaction de Baeyer-Villiger. Dans les cétones cycliques, l'oxydation avec des peracides génère des lactones. Les groupes attachés aux cétones asymétriques ont une capacité migratoire, ce qui permet, au sens littéral, "d'insérer un atome d'oxygène" entre le groupe carbonyle et le groupe migrant, produisant ainsi un ester ou une lactone.
Il faut tenir compte du fait que les énones (cétones insaturées α, β) ne sont pas de bons substrats pour l'oxydation Baeyer-Villiger, car l'alcène est beaucoup plus réactif que la cétone. Cependant Il existe des structures particulières où l'alcène peut être protégé par un substituant proche du fait de l'effet stérique et ainsi diriger l'attaque du peracide vers le groupe carbonyle.
|
|
… |
|
Rappelons que l'aptitude migratoire des différents groupes, dans la réaction de Baeyer-Villiger, est la suivante :
H> Ph> 3º alkyle> cycloalkyle> 2º alkyle> 1º alkyle> Me
Proposer un plan de synthèse pour les molécules suivantes :
|
Mob 56
L-Dopa |
. |
Mob 57
|
. |
Mob 58
|
|
|
|
|
|
|
|
Mob 59
|
|
Mob 60
|
|
foule 61
|
Mob 56. Analyse rétrosynthétique. L'acide alpha aminé
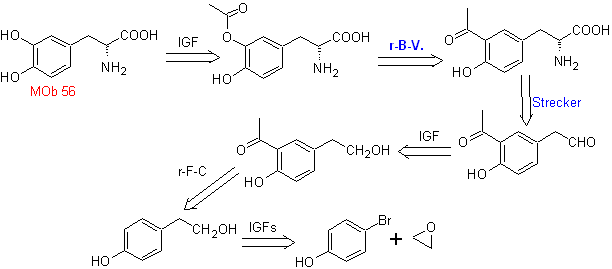
La synthèse. Pour Pour la formation du Grignard recherché, l'ortho OH du benzène est protégé. La synthèse de Strecker permet la formation de l'acide alpha aminé, qui est oxydé selon Baeyer-Villiger avec un peracide et le produit subit une hydrolyse acide du groupe ester, ce qui conduit à la formation de
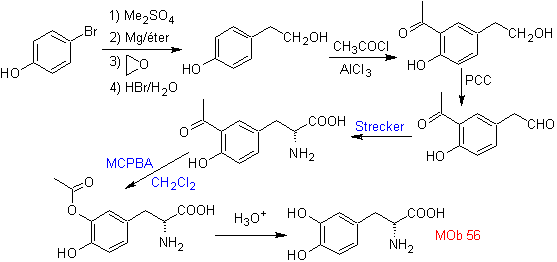
Lire la suite : L'oxydation Baeyer-Villiger comme stratégie de rétrosynthèse
- Détails
- Wilbertrivera
- SYNTHESE ORGANIQUE
- Affichages : 30363
La transposition de Beckmann comme stratégie dans
Le réarrangement des oximes en milieu acide, appelé réarrangement de Beckman, produit un amide ou un lactame si la cétone de départ est respectivement linéaire ou cyclique.
Pour améliorer les performances de ce type de réaction, différents catalyseurs et milieux acides ont été étudiés. Ainsi, par exemple, de nouveaux milieux acides utilisés comme catalyseurs, dans le but indiqué, sont : TCT/DMF, DAST/CH 2 CL 2 , CF 3 SO 3 H, PCl 5 , HgCl 2 /MeCN et le ZnO.
|
TCT :
trichlorotriazine |
…… |
DAST :
trifluorure de diéthylaminosulfure |
L'aptitude migratoire des groupes est la même que dans la réaction de Baeyer-Villiger. Proposer un design de synthèse pour chacune des molécules suivantes :
|
|
Mob 62
|
|
foule 63
|
|
Mob 64
|
Mob 62 . Analyse rétrosynthétique.
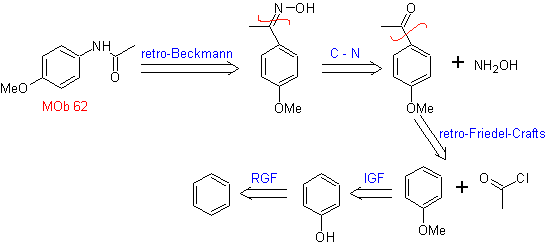
La synthèse. La réaction de la cétone aromatique intermédiaire avec NH 2 OH et son traitement ultérieur avec une solution aqueuse d'acide sulfurique et de ZnO, permet la formation de la amide aromatique MOb 62.
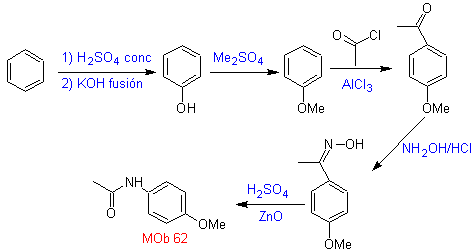
Lire la suite : Le réarrangement de Beckmann comme stratégie en rétrosynthèse
- Détails
- Wilbertrivera
- SYNTHESE ORGANIQUE
- Affichages : 21005
Autres stratégies de synthèse utilisant des syntons « illogiques »
1. addition de triple liaison
La stratégie de « rajouter » une triple liaison, entre deux fonctions oxygénées en position 1,4, permet de travailler ultérieurement avec une déconnexion basée sur la chimie des acétylures. Afin d'illustrer cette stratégie, voyons l'élaboration d'un plan de synthèse pour
Foule. 40. Analyse rétrosynthétique . Un premier IGF en
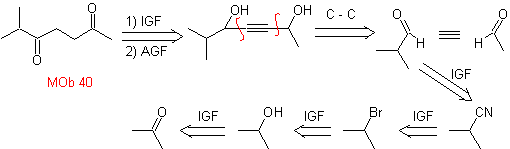
La synthèse. Le diacétylure ou acétylure par étapes, se combine avec des molécules de différents aldéhydes, la molécule intermédiaire formée est hydrogénée puis ses alcools sont oxydés en composé dicétonique Mob 40.
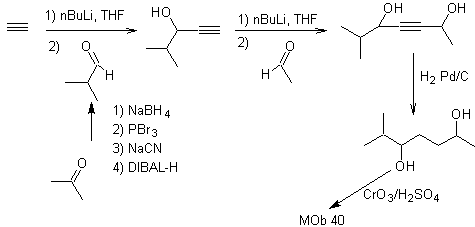
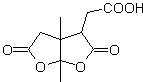
Les γ-lactones peuvent également être préparées de manière analogue, comme indiqué ci-dessous :

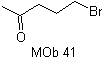
2. Ajout du groupe COOR comme groupe d'activation
L'ajout du groupe COOR, en plus d'activer l'anion synthon, facilite la déconnexion d'une molécule 1,4 diX.
|
synthétiser |
|
MOb 41. Analyse rétrosynthétique.
Lire la suite : Autres stratégies de synthèse utilisant des syntons "illogiques"
- Détails
- Wilbertrivera
- SYNTHESE ORGANIQUE
- Affichages : 51192
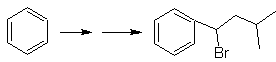
SYNTHESE DES COMPOSES AROMATIQUES I
(Méthode de l'arbre de synthèse)
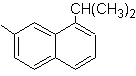
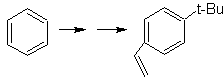
Proposer un plan de synthèse, utilisant le toluène ou le xylène comme matières premières, pour les molécules suivantes :
|
(Mob 12)
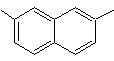
1-isopropyl-7-méthylnaphtalène |
(Mob 13)
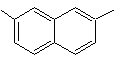
2,7-diméthylnaphtalène |
|
|
|
|
(Mob 14)
1-isopropyl-6-méthylnaphtalène
|
(Mob 15)
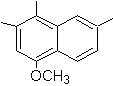
4-méthox-1,2,7-triméthylnaphtalène |
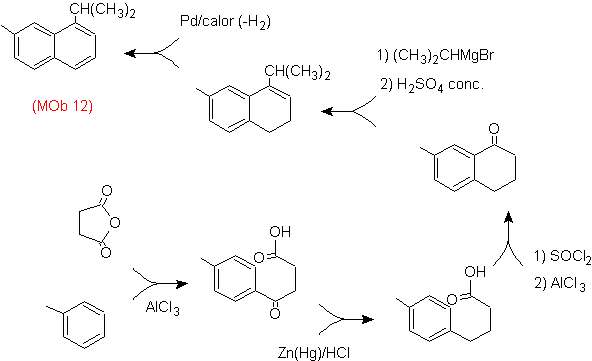
Solution : (MOb 12).
Dans la stratégie retenue, on tient compte du fait que la dernière étape peut répondre à un processus d'"aromatisation", pour lequel il est proposé que la molécule précurseur présente un cycle non aromatique, avec une double liaison. sur le carbone contenant la double liaison et le groupe alkyle.
Cette structure peut être obtenue par l'action d'un Grignard sur un carbonyle et la déshydratation subséquente de l'alcool formé. La cétone est formée par acylation sur le composé benzénique approprié avec de l'anhydride succinique et ses fermetures d'acylation intramoléculaire Friedel-Crafts ultérieures.
Solution (MOb 13).
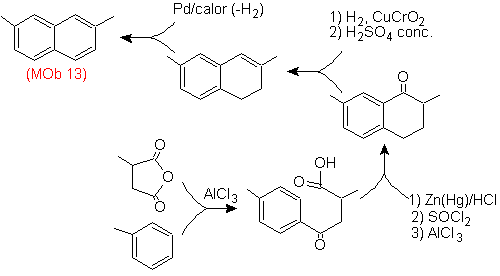
Encore une fois, la molécule précurseur doit être "aromatisée", la stratégie la plus appropriée parmi d'autres Il est basé sur la combinaison de l'acylation avec l'anhydride succinique substitué et la réduction de Clemmensen.
Le carbonyle final est réduit en alcool qui sera ensuite déshydraté avec de l'hydrogène moléculaire et un catalyseur appelé cuivre chromyle.
- Détails
- Wilbertrivera
- SYNTHESE ORGANIQUE
- Affichages : 29418
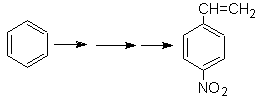
SYNTHESE DES COMPOSES AROMATIQUES II
(Méthode de l'arbre de synthèse)
Bien qu'un des premiers problèmes à résoudre dans la synthèse des composés aromatiques multisubstitués soit le contrôle des effets d'orientation et de la formation d'isomères indésirables, il est également important d'étudier la réactivité des arènes, puisqu'à un moment donné de la sens de la présence de groupes aliphatiques dans le composé aromatique, à plusieurs reprises, ils présentent des caractéristiques et des réactivités, typiques du type de composé organique auquel ils appartiennent et celles particulières qui résultent de l'interaction mutuelle des groupes aliphatiques et aromatiques.
Dans ce but, il est basé, le synthèse des molécules n°20 à 27, cette fois à partir de matériaux spécifiés, la question est donc présentée comme suit : quelles sont les réactions qui Justifier les transformations suivantes ?
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
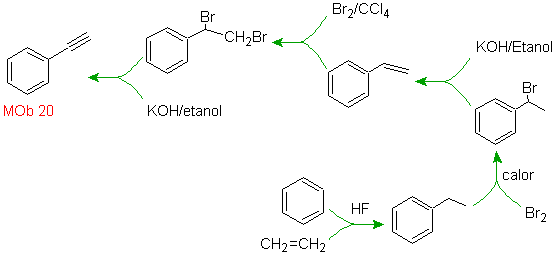
Solution Mob 20.
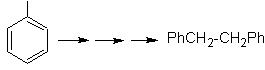
Nous savons qu'il n'y a aucune possibilité que l'ion acétylure agisse directement sur le benzène, donc la triple liaison est obtenue à partir d'un groupe alkyle vec-dibromé, qui est obtenu par bromation du styrène, précédemment obtenu par déshydrobromation d'un halogénure de benzyle formé par une bromation par voie radicalaire sur l'éthylbenzène
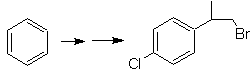
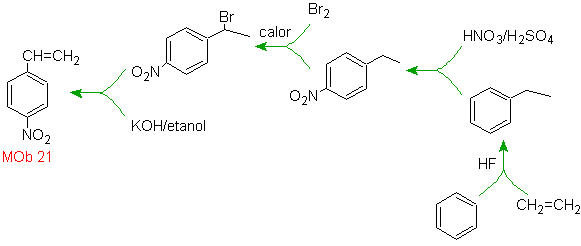
Solution Mob 21.
Le para nitrostyrène ne peut pas être obtenu par nitration directe du styrène, car le groupe éthényle attaché au cycle est instable dans les conditions de nitration.
Ainsi, la molécule précurseur aura un groupe facile à déshydrobromer. Ce précurseur est obtenu par bromation radicalaire du groupement éthyle lié au cycle benzénique, préalablement nitré principalement en position para.
- Détails
- Wilbertrivera
- SYNTHESE ORGANIQUE
- Affichages : 32780
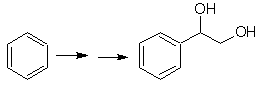
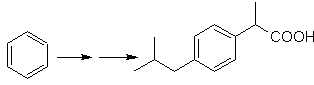
SYNTHÈSE DE ALCOOLS
(Méthode de l'arbre de synthèse)
Proposer un plan de synthèse pour les molécules cibles indiquées à partir des molécules individuelles indiquées (MOb 30 -41). Pour cela, utilisez les réactifs et les conditions de réaction que vous jugez nécessaires :
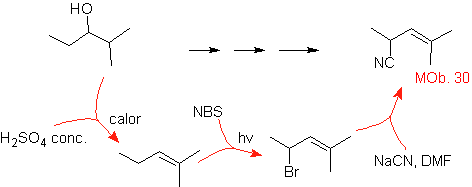
Solution MOb 30.
Stratégie : On observe que la molécule de départ a été déshydratée et en position allylique initialement non substituée, un hydrogène a été déplacé par le groupement cyano ou nitrile. Cette dernière réaction ne peut se produire que si la molécule précurseur est un halogénure allylique, c'est pourquoi elle est proposée comme précurseur de
Le Br est introduit à l'endroit souhaité avec le NBS et l'alcène est le produit de la déshydratation de la molécule de départ.
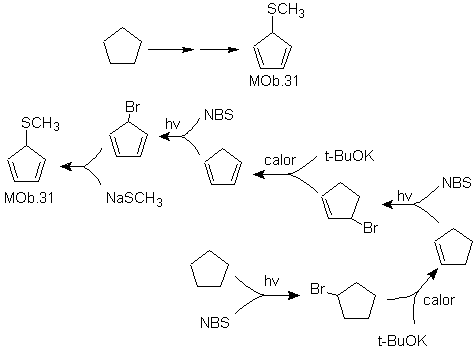
Solution MOb 31.
Stratégie : C'est un oncle éther, la molécule précurseur nécessaire sera un halogénure de 1,3-cyclopentadiène.
Cet halogénure est préparé par l'action du NBS sur le cycloalcène diénique, qui à son tour est préparé par la déshydrobromation de la molécule précurseur, qui est atteinte par l'action du NBS sur le cycloalcène formé. préalablement par déshydrohalogénation de la molécule de départ bromée par des radicaux
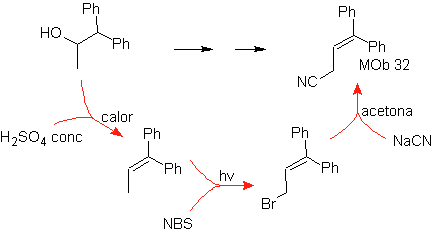
Solution Mob 32.
Stratégie : Elle est similaire à celle utilisée pour obtenir
- Détails
- Wilbertrivera
- SYNTHESE ORGANIQUE
- Affichages : 24866
Synthèse d'hétérocycles par cyclisation intermoléculaire
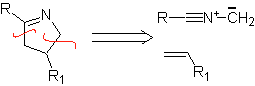
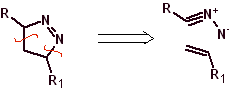
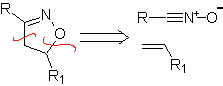
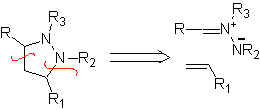
1. Cyclisations 1,3-dipolaires
Ces réactions forment normalement des hétérocycles à cinq chaînons, pour lesquels la réaction entre un composé dipolaire n1,3 et un alcène est nécessaire. La réaction est une [3-2] cycloaddition. Les composés 1,3-dipolaires qui ont eu le plus d'utilisation pour former des hétérocycles pentagonaux sont :
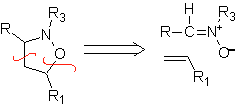
Azides, diazoalcanes, protoxyde d'azote, nitrile imines, oxydes de nitrile, azométhylène imines, composés azoxy, ylures d'azométhane, nitrones, oxydes de carbonyle et ozone.
Les cyclisations et déconnexions suivantes sont assez courantes, montrant la large gamme de réactifs 1,3-dipolaires et leurs structures de résonance ou tautomères utilisés dans le but de former des hétérocycles pentagonaux.
 |
 |
 |
 |
 |
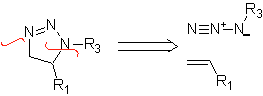 |
Le mécanisme généralement accepté de la réaction 1,3-dipolaire répond à une réaction concertée.
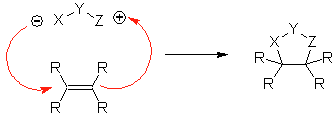
Proposer un plan de synthèse pour les molécules suivantes :
| Mob : 86
|
. |
Mob : 87  |
.. |
Mob : 88 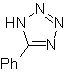 |
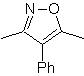
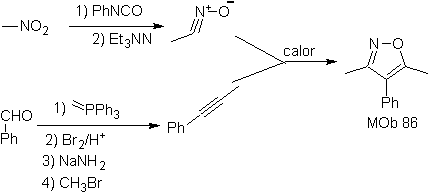
MOb 86
. Analyse rétrosynthétique
.
, est un dérivé de l'isoxazole. Sa déconnexion peut être orientée vers l'utilisation d'un oxyde de nitrile et d'un dérivé acétylénique.
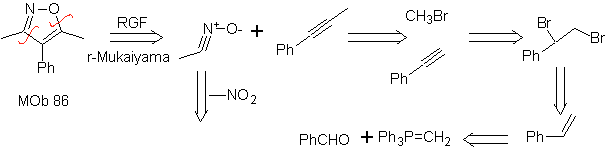
La synthèse. L'oxyde de nitrile peut être préparé à partir de nitrométhane par la réaction de Mukaiyama. Le dérivé acétylénique, issu du benzaldéhyde, faisant croître la chaîne avec insaturation, auparavant, avec la réaction de Wittig. Le diène polaire et le diénophile formé se combinent selon Diels-Alder pour former
86.
Lire la suite : Synthèse d'hétérocycles par cyclisation intermoléculaire