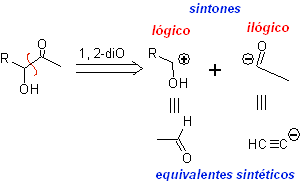
I composti α-idrossicarbonilici sono disconnessi al legame CC che unisce le due funzioni. Questa operazione porta a un synthon naturale o logico (il synthon cationico) ea un synthon innaturale o illogico (il synthon anionico). Gli equivalenti sintetici possono essere rispettivamente aldeidi e ione acetiluro.
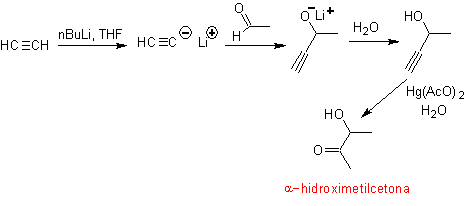
Il gruppo terminale dell'acetilene con sali di mercurio in un mezzo acido forma un metilchetone. Questa reazione è utile anche se il gruppo acetilene è interno e anche simmetrico.
Un caso particolare di α-idrossichetoni sono i benzoini o i diarilidrossichetoni , dove i due gruppi R sono aromatici o eterociclici. I benzoini sono il risultato dell'autocondensazione della benzaldeide catalizzata da ioni cianuro.
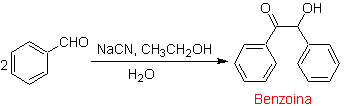
I benzoini possono non essere simmetrici, per esempio una delle aldeidi può essere una piridina aldeide. Lo ione cianuro non catalizza le aldeidi alifatiche, che subiscono lo stesso accoppiamento in presenza di sali di tiazolio.
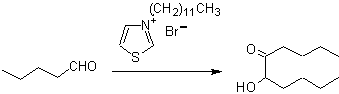
Gli α-idrossichetoni alifatici possono essere formati dalla condensazione di esteri carbossilici con sodio metallico in un solvente inerte e sotto riflusso. Questi idrossichetoni sono chiamati aciloine e le reazioni di condensazione possono avvenire a livello intramolecolare e intermolecolare.
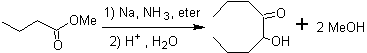

I composti raggruppati sotto il nome di acidi ossocarbossilici , che comprendono aldeidoacidi e chetoacidi, sono di grande importanza nelle serie alifatiche sia per la loro relazione biochimica con gli ossacidi, sia per le reazioni di sintesi che da essi possono avvenire o I suoi derivati costituiscono un importante gruppo di composti organici, sui quali si sta lavorando intensamente in tempi recenti.
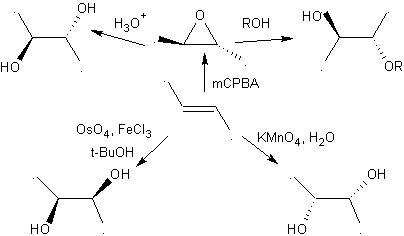
2.- Composti 1,2-dioli Gli 1,2-dioli hanno nelle olefine i migliori precursori per la loro preparazione, dipenderà solo dalla stereochimica del diolo in questione, ricorrere ad una delle reazioni specifiche riassunte nella tabella allegata.
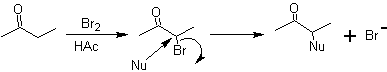
Le molecole 1,2-diossigenate possono anche essere costruite usando elettrofili illogici; I reagenti più importanti di questo tipo sono i composti carbonilici alfa-alogenati ottenuti per alogenazione della forma enolica di un composto carbonilico.
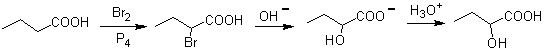
Un altro metodo che produce composti 1,2-difunzionalizzati consiste nella scissione ossidativa di doppi legami da parte dell'ozono per generare due carbonili, che varieranno a seconda delle condizioni di reazione.
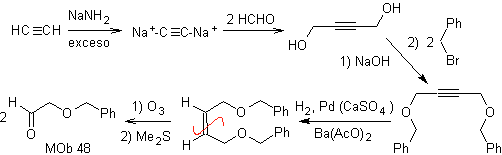
| Cellula 48:
|
Analisi retrosintetica. la folla 48 è un etere olefinico asimmetrico e con il gruppo aldeide ad un'estremità, motivo per cui si può presumere che sia il risultato dell'apertura di un doppio legame per ozonolisi seguita dalla reazione con Me 2 S. Il doppio legame del precursore è funzionalizzato a un alchino interno etereo simmetrico.
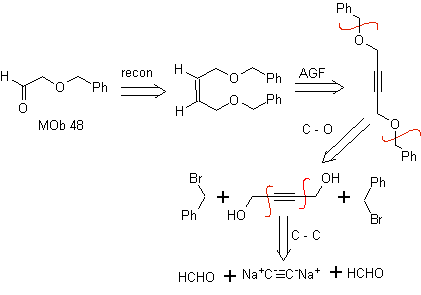
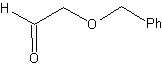
Gli eteri sono il risultato dell'applicazione della sintesi di Williamson e del diolo della reazione del diacetilide sulle aldeidi, come materiale di partenza.
sintesi . Il diacetilide è fatto con un eccesso di sodammide, che agisce senza formaldeide, per dare l'alcool, che viene eterificato da Williamson. L'alchino viene ridotto ad un alchene che viene aperto mediante ozonolisi, seguita dalla reazione con Me 2 S per formare l'aldeide.
sintesi . Il diacetilide è fatto con un eccesso di sodammide, che agisce senza formaldeide, per dare l'alcool, che viene eterificato da Williamson. L'alchino viene ridotto ad un alchene che viene aperto mediante ozonolisi, seguita dalla reazione con Me 2 S per formare l'aldeide.