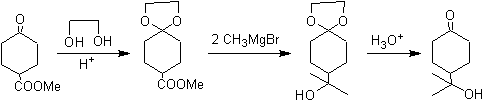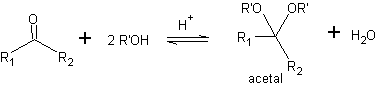ОРГАНИЧЕСКИЙ СИНТЕЗ
- Информация о материале
- Wilbertrivera
- ОРГАНИЧЕСКИЙ СИНТЕЗ
- Просмотров: 45256
МЕТОДОЛОГИИ ОРГАНИЧЕСКОГО СИНТЕЗА
Полный синтез органического соединения каждый раз требовал бы начинать с элементов, из которых оно состоит. Однако хорошо известно, что из элементов можно получать простые органические соединения, такие как мочевина, метан, метанол, ацетилен, уксусная кислота, этанол и так далее, можно строить все более сложные структуры.
Однако это не практично и не необходимо, поскольку существует большое количество органических соединений, которые коммерчески доступны или экономически доступны, и их можно использовать в качестве исходных материалов. Строго говоря, все они происходят из элементов, из которых они состоят или могут быть получены из них, поэтому любой синтез, предпринятый из этого сырья, будет «формально» тотальным синтезом.
Методологии синтеза, необходимые для успешного синтеза, менялись с течением времени и развитием самой химии как науки, поэтому известны следующие:
- Методика «прямой ассоциации»
- Методология «промежуточного подхода»
- Методика «логического анализа»
- Информация о материале
- Wilbertrivera
- ОРГАНИЧЕСКИЙ СИНТЕЗ
- Просмотров: 30240
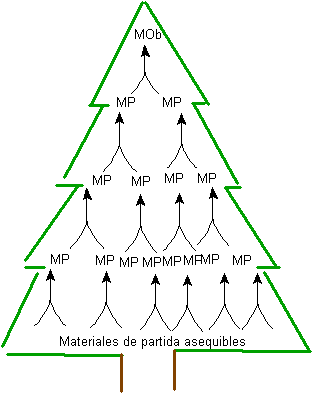
Разработка « дерева синтеза », основанного на создании промежуточных молекул или молекул-предшественников, шаг за шагом в противоположном направлении (ретросинтез), то есть, начиная с целевой молекулы, представляет собой метод, который можно лучше понять, рассмотрев следующие общие принципы . указанного процесса.
1. Начните с окончательной структуры (MOb). Начиная с конечной структуры, молекулы-мишени, работайте в обратном направлении (ретросинтез), пока не будет получено легкодоступное сырье. Если исходное сырье указано в задаче синтеза, это ограничивает только количество возможных путей синтеза, которые необходимо решить.
2. Характеристика молекулы-мишени (MOb ). При изучении строения молекулы-мишени необходимо ответить на следующие вопросы:
к. Что это за соединение?
б. Какие функциональные группы он содержит?
в. Какова природа углеродного скелета?
д. Имеет ли молекула нормальную или разветвленную алкильную цепь?
и. Содержит ли он кольца и являются ли они циклоалкильными или ароматическими?
Ф. Обладает ли MOb фактической или потенциальной симметрией?
3. Функциональная группа . В связи с этим неплохо было бы также ответить на следующие вопросы:
к. Известны ли реакционная способность, чувствительность и нестабильность функциональных групп, которыми обладает MOb?
б. Какие общие методы доступны для его приготовления?
в. Какой из них применим к конкретной функциональной группе проблемной молекулы?
4. Стереохимические аспекты . Будет проанализировано в МОБ, желательно:
к. центры хиральности
б. Форма и конфигурация колец
в. Эффекты близости между группами
5. Карбонатный скелет . Основной проблемой в большинстве органических синтезов является построение углеродного скелета. Обмен функциональных групп (IGF) часто легко осуществить, например, кетон на спирт, альдегид на кислоту или спирт на бромид. Вопросы, которые задаются относительно построения звеньев СС, связаны с теми, которые уже поднимались относительно функциональной группы.
к. Применимы ли некоторые из доступных методов формирования функциональных групп для создания ссылок CC?
б. Совместим ли метод с конкретным углеродным скелетом молекулы-мишени? Если это не так.
в. Существует ли процедура формирования углеродной цепи, производящей конвертируемую функцию в требуемую?
6. Молекулы-предшественники (PM)
Анализ структуры молекулы-проблемы и рассмотрение вопросов, поставленных на этапах с 1) по 5), приведет к двум возможным типам молекул-предшественников. Один из них содержит функциональную группу, эквивалентную таковой конечной структуры.
Другой представляет собой соединение с меньшим количеством атомов углерода, чем молекула-мишень. Когда последние объединяются, достигается окончательная углеродная цепь и требуемая функциональность.
Генерация любого из этих типов молекул-предшественников должна привести к упрощению проблемы.
В общем, если проецируемый путь ведет к предвестникам, синтезировать которые труднее, чем сама проблема (цель), необходимо искать другой путь.
Рис. 1. ДЕРЕВО СИНТЕЗА
Генерация молекул-предшественников, до достигнув исходных материалов, порождает ряд структур, которые вместе образуют своеобразное дерево, рис.1. Отсюда и название синтетического метода.
- Информация о материале
- Wilbertrivera
- ОРГАНИЧЕСКИЙ СИНТЕЗ
- Просмотров: 36446
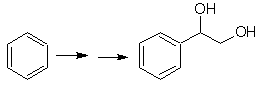
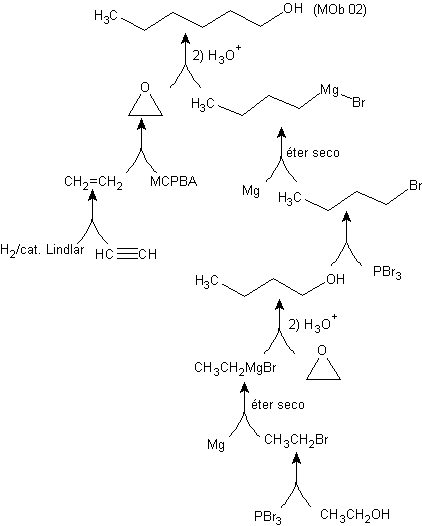
Синтез н-гексанола ( MOb 02)
Решение : н-гексанол (MOb 02) представляет собой первичный спирт, углеродная цепь которого не имеет ответвлений. Таким образом, стратегия сводится к поиску реакций, которые позволяют цепочке нарастить достаточное количество атомов углерода. Нецелесообразно, чтобы наращивание цепочки происходило по одному, так как этот путь привел бы к плану синтеза с большим количеством стадий, следовательно, с низким выходом.
Таким образом, раскрытие эпоксидных колец соединением Гриньяра может быть достаточным для этой цели; так как его также можно сочетать с ацетиленовым синтезом (использование производных ацетилида натрия и последующее насыщение тройной связи).
Эпоксид, необходимый для соединения с Гриньяром, получают из алкена и надкислоты. Таким образом, выводится настоящий план синтеза, где исходными материалами могут быть ацетилен и этанол.
- Информация о материале
- Wilbertrivera
- ОРГАНИЧЕСКИЙ СИНТЕЗ
- Просмотров: 41584
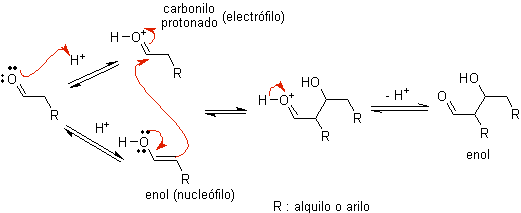
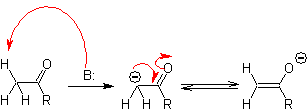
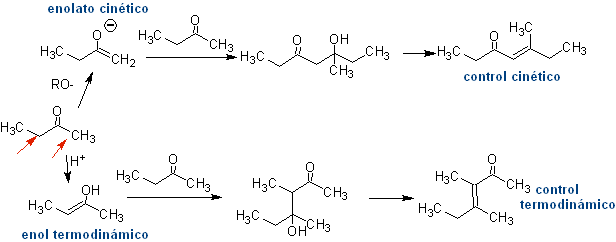
Образование енолов и енолятов
Альфа -углерод соединений, содержащих карбонильную группу (альдегиды, кетоны, сложные эфиры, дикетоны, диэфиры, нитраты, нитрилы и др.), является центром многих реакций образования СС-связи. Из-за кислотности H a они подвергаются -депротонированию в присутствии подходящего основания с последующим образованием карбаниона. Результирующий отрицательный заряд от C a до C=O резонансно стабилизируется той же карбонильной группой.
Выбор основания для образования енолятов обусловлен тем, что рКа кислоты, сопряженной с основанием, должно быть больше по крайней мере на три единицы, чем рКа карбонильного соединения, имеющего кислые Н ' .
| рК а = 20 | МеО- рК а = 15 | Неблагоприятное образование енолятов |
| рК а = 10 | tBuO- _ рК а = 19 | Очень благоприятное образование енолятов |
Образование енолятов:
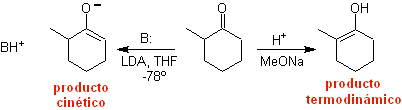
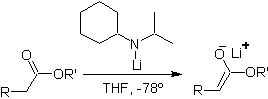
¨ Кинетический енолят
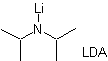
Это происходит из-за того, что субстрат имеет H α , легко доступный для депротонирования через типичное основание, такое как LDA (pKa
приблизительно 30) LDA (диизопропиламид лития) представляет собой сильное, ненуклеофильное, стерически затрудненное основание. |
|
¨
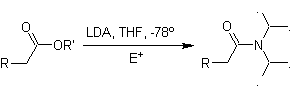
Еноляты сложных эфиров:
Сложные эфиры восприимчивы к реакции замещения основания, LDA может быть проблематичным, поэтому ненуклеофильное основание (изопропилциклогексиламид лития) используется со сложными эфирами.
¨
Термодинамический енолят:
Обратимое депротонирование может привести к более стабильным енолятам, что происходит при получении более замещенной С=С енольной формы.
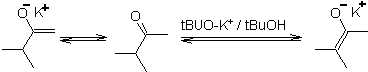
Типичные условия для образования термодинамических енолятов: RO-M+ в ROH в качестве протонного растворителя (pKa ROH = 15-18).
Кинетические и термодинамические еноляты могут быть уловлены, выделены, разделены и очищены для получения региохимически чистых енолятов. Это может быть достигнуто за счет образования ацетатов енола и силиленового эфира.
- Информация о материале
- Wilbertrivera
- ОРГАНИЧЕСКИЙ СИНТЕЗ
- Просмотров: 45510
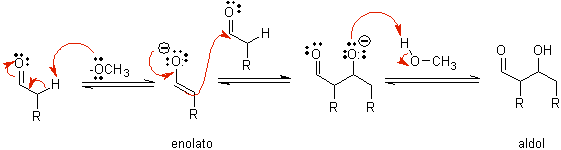
Реакции енолов и енолятов
Альдольные реакции и так называемые реакции конденсации карбонильных соединений и др. этого типа, способные образовывать енольную и енолятную структуры, участвуют в большой группе важных реакций, позволяющих понять существование огромного числа молекул, образующихся в результате взаимодействия енолов или енолятов с рядом электрофильных групп.
Изучение этого типа реакций позволило проверить и установить существование двух механизмов реакции, посредством которых они протекают, как поясняется ниже:
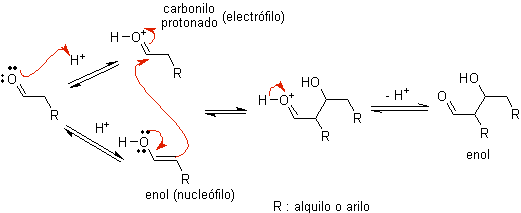
К)
Когда в качестве катализатора используется кислота , карбонильное соединение сначала протонируется, а затем таутомеризуется до его енольной формы , которая является нуклеофилом на альфа-углероде по отношению к карбонильной группе. Той же кислой среды достаточно, чтобы активировать карбонильную группу другой молекулы, делая ее высокоэлектрофильной, что создает оптимальные условия для образования ненасыщенного карбонильного соединения.
Реакция обычно протекает до тех пор, пока не образуется дегидратация енола, катализируемая той же кислотой реакции.
Б) Когда катализатор представляет собой основание, такое как алкоксид, реакция альдольного типа протекает посредством нуклеофильной атаки резонансно-стабилизированного енолята на карбонильную группу другой молекулы.
При дегидратации альдола, катализируемой основанием, образуется обезвоженный конечный продукт.
Как и в предыдущем случае, дегидратация, катализируемая основанием (иногда описываемая как одностадийная), позволяет контролировать реакцию и получать дегидратированный конечный продукт. В некоторых случаях образование енолятов носит необратимый характер.
как это выглядит в некоторых случаях требуется только каталитическое количество основания, наиболее обычная процедура заключается в использовании estequiométrica количества сильного основания, такого как LDA или NaHMDS . В этом случае образование енолята является необратимым, и альдольный продукт не образуется до тех пор, пока алкоксид металла альдольного продукта не будет протонирован на более поздней стадии.
- Информация о материале
- Wilbertrivera
- ОРГАНИЧЕСКИЙ СИНТЕЗ
- Просмотров: 35054
Органический синтез, сердце органической химии , является по существу эвристической деятельностью, то есть это процесс, в котором высоко предсказуемая творческая деятельность логического мышления и эмпирических процедур, богатых художественной проработкой, сливаются воедино, что делает химика-органика настоящим новатором.
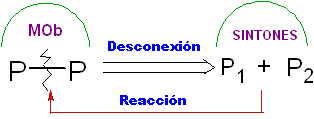
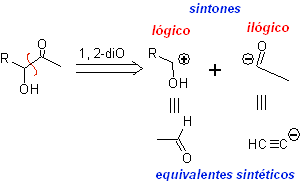
Как и любой метод, « метод отключения или синтона » имеет свою структуру, символику и язык, которые должны быть изначально усвоены и поняты теми, кто готов использовать этот синтетический инструмент.
Метод синтеза разъединений или синтона , включает Две фазы;
![]() Фаза ретросинтетического анализа . На ней показаны все преобразования, которые будут проведены в процессе упрощения структуры
Фаза ретросинтетического анализа . На ней показаны все преобразования, которые будут проведены в процессе упрощения структуры
![]() Фаза синтеза . Где то, что является «мыслью», основанной на критериях механистической рациональности и реакционной способности органических соединений, материализуется в маршруте синтеза, который будет прописан, как это ожидается в химической лаборатории. Именно здесь возникает опыт и проявляется « искусство делать или изобрести » химика, т.е.
Фаза синтеза . Где то, что является «мыслью», основанной на критериях механистической рациональности и реакционной способности органических соединений, материализуется в маршруте синтеза, который будет прописан, как это ожидается в химической лаборатории. Именно здесь возникает опыт и проявляется « искусство делать или изобрести » химика, т.е.
термины, определения или операции синтеза, периодически используемые в этом методе, следующие:
Молекула-мишень (MOb) .
Это название, данное любой молекуле, которая должна быть синтезирована или приготовлена из простых и доступных материалов, которая в задаче может быть предварительно определена или адаптирована к вариантам, которые химик генерирует в своем плане или дизайне синтеза.
трансформация . ( ![]() ).
).
Специальную однонаправленную стрелку ретросинтеза следует понимать как символическое представление выражения « изготавливается из », а также представляет собой какое-то преобразование в структуре
Упомянутые типы трансформации на самом деле представляют собой ретросинтетические операции , такие как: разъединение, повторное соединение, перегруппировка, взаимопреобразование функциональных групп (IGF), добавление функциональных групп (AGF), удаление функциональных групп (SGF) и т. д.
Отключение.
Это ретросинтетическая операция, которая представляет собой воображаемый разрыв химических связей, которые должны были образоваться в молекуле-мишени из синтонов или, точнее, из их синтетических эквивалентов (молекул-предшественников), постулируемых.
Его можно понимать как обратную химическую реакцию, он представлен стрелкой (сильно отличающейся от химической реакции или условий равновесия) и перечеркнутой волнистой линией над связью, которая будет «разъединена».
Можно даже поставить предлагаемое отключение на стрелку: CC, CS. СХ, СО, CN. и т.д.. Выражения, связывающие нас с типом реакции, которая будет использована при образовании
В других случаях используемая модель отключения может быть записана, например, обычно встречается: 1,3-диО, 1,4-диСО, 1,5-диСО или α,β- инсатСО . И т. д.
Следовательно, в диоксигенированной молекуле можно ожидать следующих разрывов:
![]() гетеролитические разрывы,
гетеролитические разрывы,
![]() Гомолитические или радикальные разъединения
Гомолитические или радикальные разъединения
![]() Электроциклические отключения
Электроциклические отключения
![]() Изменить порядок отключений
Изменить порядок отключений
- Информация о материале
- Wilbertrivera
- ОРГАНИЧЕСКИЙ СИНТЕЗ
- Просмотров: 27330
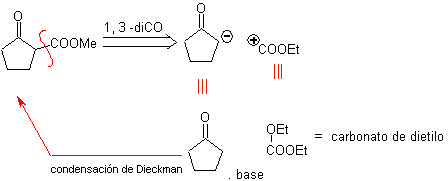
РАЗЪЕДИНЕНИЕ 1,3-ДИОКИСЛОРОДНЫХ СОЕДИНЕНИЙ
Оксигенированные органические соединения наиболее распространены в природе, особенно диоксигенаты, поэтому многие исследователи-химики смоделировали ретросинтетическое разъединение этих молекул, аспект, который будет изучен в следующих параграфах.
Начнем с того, что модели разъединения диоксигенированных молекул были разделены на две большие группы, основанные на природе синтонов, которые генерируются при применении к синтезируемой молекуле базовой синтетической операции, называемой « РАЗЪЕДИНЕНИЕ» , и на том, что, как правило, это называется молекулой-мишенью (MOb) .
Эти большие группы:
![]() « Логические » модели отключения и
« Логические » модели отключения и
![]() « Аномальные » или « нелогичные » модели отключения
« Аномальные » или « нелогичные » модели отключения
Так называемые «логические» модели разъединения — это модели, в которых путем «разрыва» одной или нескольких химических связей в
Соединения, которые можно классифицировать как 1,3-диоксиген и 1,5-диоксиген, при ретросинтезе обычно образуют синтоны, считающиеся «логичными». С другой стороны, органические молекулы, родственные 1,2-диоксигенатам, 1,4-диоксигенатам и 1,6-диоксигенатам, генерируют синтоны.
считается «нелогичным»
Модель отсечки 1,3-дикислорода
![]() β-дикарбонильные соединения
β-дикарбонильные соединения
1,3-дикарбонильные соединения получают с хорошими выходами в результате реакций конденсации типа Кляйзена, которые включают реакцию между сложными эфирами и соединениями с активными атомами водорода, такими как: сложные эфиры, кетоны, альдегиды, нитрилы, нитропроизводные и некоторые углеводороды в присутствии щелочные реагенты.
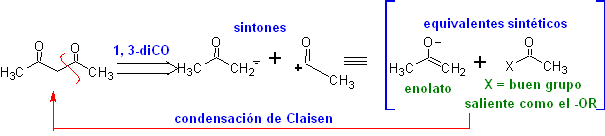
Бета-дикетоны и бета-кетоальдегиды получают перекрестной конденсацией Кляйзена с использованием подходящего кетона и сложного эфира. В перекрестной конденсации Клайзена кетонов и эфиров получаются хорошие выходы, поскольку кетоны заметно более кислые, чем эфиры, поэтому в основной среде кетон депротонируется в большей степени, чем эфир.
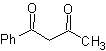
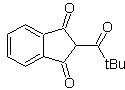
Примеры : Предложите план синтеза из простых материалов для следующих молекул:
Моб 16
| моб 17
| МОБ 18
|
Решение:
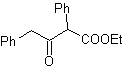
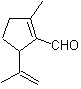
МОБ 16 . По-видимому, два варианта отключения (а) и (б), показанные на рис.
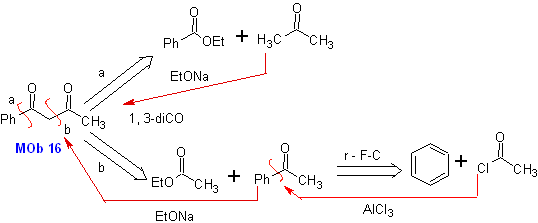
Однако вариант (б) оказывается наиболее подходящим, так как в основной реакционной среде карбанион, образующийся PhCOCH 2 - будет лучше стабилизирован за счет резонансного и индуктивного эффектов.
- Информация о материале
- Wilbertrivera
- ОРГАНИЧЕСКИЙ СИНТЕЗ
- Просмотров: 25217
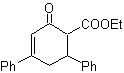
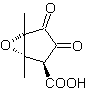
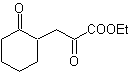
1,5-диоксигенированные соединения, как правило, являются результатом сопряженных реакций присоединения нуклеофилов из карбонильных соединений, с кислыми H α (енолами, енолятами, енаминами и др.), а также нитрилами и нитратами, на субстратах, альфа-бета-ненасыщенных в отношении к карбонильным группам и т.п., известной как реакция Михаэля, с дополнительными вариантами, представляющими собой реакцию Нефа и реакцию аннелирования (аннелирования) Робинсона.
Отключите модель 1, 5 диоксиген (1,5-диО)
Модель разъединения 1,5-диО может быть применена после необходимой функционализации к таким соединениям, как: 1,5-дигидроксилы, 1,5-гидроксиальдегиды, 1,5-гидроксикетоны, 1,5-гидроксиэфиры, 1,5- кетоальдегиды, 1,5-дикетоны, 1,5-кетоэфиры, 1,5-диальдегиды и др.
Возможности увеличиваются, если также принимать во внимание нитропроизводные и нитрилы, которые могут образовывать очень реакционноспособные карбанионы в основной среде, способные присоединяться к α,β-ненасыщенным карбонильным соединениям с получением продуктов типа 1,5-диО.
Фундаментальный анализ разъединения соединений 1,5-диО выглядит следующим образом:
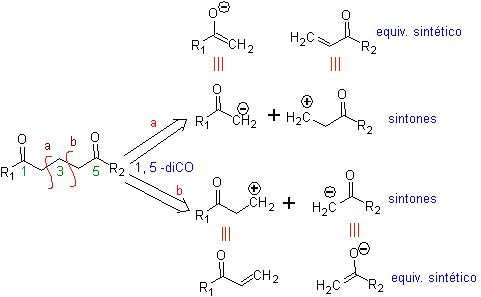
Выбор разъединения (а) или (б) вокруг С3 будет зависеть от природы групп R1 и R2, которые могут придавать большую или меньшую стабильность синтону или синтетическому эквиваленту, необходимому для образования
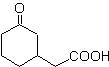
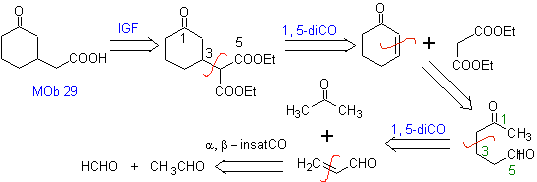
Предложите схему синтеза для MOb 29, 30 и
Моб 29
| МОБ 30
| Моб 31
|
Решение:
МОБ 29 . Ретросинтетический анализ: карбанион, необходимый для добавления к a , b- ненасыщенному соединению CO. Его можно получить из диэтилмалоната в щелочной среде. Что впоследствии вызовет декарбоксилирование, чтобы достичь
- Информация о материале
- Wilbertrivera
- ОРГАНИЧЕСКИЙ СИНТЕЗ
- Просмотров: 61040
Для работы защиты требуется следующая процедура:
·
Избирательно и в мягких условиях защищайте наиболее реакционноспособные функциональные группы.
·
Провести реакцию на требуемую функциональную группу, не затрагивая защищенную группу
·
Незащищенная функциональная группа, подлежащая защите
действие защиты должно удовлетворять следующим основным требованиям:
·
Реакция должна проходить хорошо и быть хемоселективной.
·
Новая функциональная группа должна быть стабильной в условиях реакции группы, которая будет реагировать.
·
Введенная функциональность не должна добавлять к молекуле хиральные центры, способные генерировать диастереомеры.
·
Исходная функциональная группа должна быть способна регенерироваться с хорошим выходом и без воздействия на остальную часть молекулы.
Использование протекторов должно быть сведено к необходимому минимуму, и их выбор должен быть таким, чтобы их не нужно было заменять на протяжении всего синтеза, поскольку этапы введения и удаления (снятие защиты) увеличивают стоимость и работу синтеза и снижают выход. Пример.
Кетоновая группа молекулы была защищена путем превращения ее в циклический кеталь с этандиолом в слабокислой среде, после чего эта молекула была подвергнута реакции с двумя молями фенилмагнийбромида, который действует на сложноэфирную группу, чтобы преобразовать ее в третичный спирт с двумя метильными заместителями, внесенными Гриньяром. Наконец, циклический кеталь гидролизуется для регенерации кетона.
На практике не существует идеальной защитной группы для каждой функциональности, вместо этого можно утверждать, что существует большой набор возможных защит, каждый из которых удовлетворяет вышеуказанным условиям при определенных обстоятельствах. Краткий перечень защит наиболее распространенных групп включен в следующие разделы:
ЗАЩИТА ОТ АЛЬДЕГИДОВ И КЕТОНОВ
Одним из способов защиты кетонов и альдегидов является их превращение в ацетали. Снять защиту с ацеталей можно в мягких условиях с помощью реакций кислотного гидролиза.
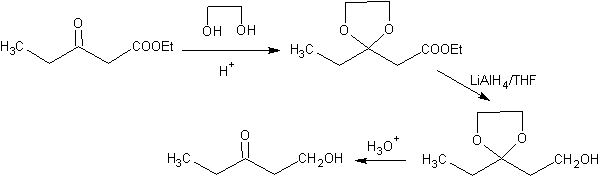
При восстановлении кетоэфира до кетоспирта. Защита кетона в виде ацеталя очень удобна, поскольку ацеталь устойчив к восстановительным условиям, в которых он будет использоваться для превращения сложноэфирной группы в гидроксильную группу.
На следующей схеме показана полная последовательность синтеза, позволяющая добиться восстановления сложного эфира без воздействия на кетон:
На первой стадии кетон превращается в циклический ацеталь реакцией с этиленгликолем в присутствии кислотного катализатора. На второй стадии эфир восстанавливают с помощью LiAlH 4 . Этот реагент не воздействует на ацеталь. Наконец, на третьей стадии спиртоацеталь обрабатывают в водно-кислой среде. В этих условиях ацеталь гидролизуется с регенерацией кетоновой карбонильной группы. Каждая из трех стадий является хемоселективной, так как на каждой из них достигается предпочтительная реакция функциональной группы.
в присутствии другого.
Подробнее: Защита функциональных групп в органическом синтезе
- Информация о материале
- Wilbertrivera
- ОРГАНИЧЕСКИЙ СИНТЕЗ
- Просмотров: 28781
Управление в органическом синтезе является одной из важнейших задач для достижения требуемого или планируемого преобразования. и/или избегать образование тех побочных продуктов, которые существенно нарушают оптимальное развитие рассматриваемого органического синтеза. Аналогичным образом, с более общей точки зрения, контроль может также включать или охватывать аспекты симметрии и избирательности.
Тогда под управлением следует понимать ряд синтетических операций, позволяющих химику сформировать углеродный скелет с заданной функциональностью или «поместить» группу или атом в нужное место или положение.
Следовательно, эти операции могут представлять собой различный набор рутинных действий с намерением, отраженным химиком, и которые требуют определенных когнитивных способностей и навыков, подобных художественным, для конструирования (синтеза) органических молекул.
Поэтому в реакциях конденсации, как и в других, контрольные операции могут быть отнесены к одной из следующих категорий.
![]() Конкурирующие реакции (самоконденсация и/или перекрестная конденсация)
Конкурирующие реакции (самоконденсация и/или перекрестная конденсация)
![]() Активация — деактивация
Активация — деактивация
![]() Селективность и специфичность
Селективность и специфичность
![]() Защита-снятие защиты
Защита-снятие защиты
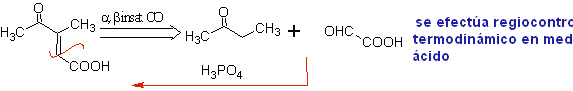
В реакциях конденсации карбонильных соединений необходимо заранее установить порядок событий, чтобы свести к минимуму или, при необходимости, подавить возможности самоконденсации и возникновения кросс-конденсации, которые, к сожалению, представляют очевидную угрозу в этих реакциях. .
самоконденсация
Все карбонильные соединения, которые имеют один или несколько альфа-атомов водорода на атомах углерода, смежных с карбонильной группой, рискуют подвергнуться реакции самоконденсации, если не соблюдать соответствующую строгость.
Так, например, если к 2-бутанону добавить негидроксилированное основание, такое как EtONa, будет образовываться енолят, который в конечном итоге может соединиться с другой молекулой того же кетона. Точно так же, если добавить H+, также может произойти самоконденсация, как можно увидеть на следующей схеме: Это можно свести к минимуму, добавляя с той же скоростью из отдельных питателей основание или кислоту к соединению, которое даст енол или енолят, и карбонильному соединению, которое будет атаковано карбонильным углеродом. . Можно использовать трехгорлую колбу и магнитную мешалку.
перекрестная конденсация
В идеале в реакциях конденсации карбонильных соединений одна из реагирующих молекул должна быстро енолизоваться, а другая предпочтительно не должна иметь Hα. , чтобы гарантировать, что никакие другие побочные продукты не образуются
Анализируемый ниже ретросинтез является хорошим примером того, на что указывалось ранее.
- Информация о материале
- Wilbertrivera
- ОРГАНИЧЕСКИЙ СИНТЕЗ
- Просмотров: 25543
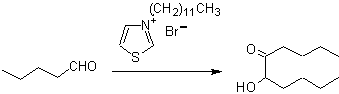
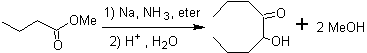

- Информация о материале
- Wilbertrivera
- ОРГАНИЧЕСКИЙ СИНТЕЗ
- Просмотров: 26183
ОТКЛЮЧЕНИЕ 1,4-ДИОКИСЛОРОДНЫХ СОЕДИНЕНИЙ
Другая группа соединений, имеющих большое значение в химическом синтезе, состоит из диоксигенированных молекул, которые находятся в соотношении расстояний 1,4. Эти соединения при ретросинтетическом анализе разрыва генерируют синтоны, причем один из них, электрофил или нуклеофил, можно считать «аномальным» или «нелогичным», поскольку заряд, приписываемый одному из атомов, не может быть объяснен в с точки зрения его внутренней или индуцированной электроотрицательности.
1. Соединения 1,4-дикислорода (1,4-диО)
В соединениях этого типа разрыв также приводит к логическому синтону и к другому нелогичному (неприродному) синтону, который может быть нуклеофилом или электрофилом, чей синтетический эквивалент еще должен быть адекватно переработан, чтобы его можно было использовать в реакция химия.
1. 1. Соединения 1,4-дикарбонил
1.1.1. 1,4-дикетоновые соединения
Варианты отключения этого типа соединений или молекул, подлежащих синтезу (MOb), могут привести к следующим вариантам:
к. Синтон логического аниона и синтон нелогичного катиона
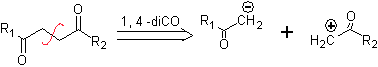
Синтетический эквивалент аниона представляет собой енолят-ион или сам енол карбонильного соединения. Вместо этого синтетическим эквивалентом карбокатиона является альфа-галогенкарбонил. (Умполунг)
б. Синтон логического катиона и синтон нелогичного аниона
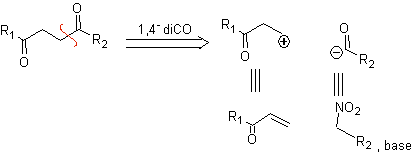
Синтетический эквивалент синтона логического катиона представляет собой α,β-ненасыщенное карбонильное соединение. Подходящим синтетическим эквивалентом синтона аниона может быть анион нитроалкана. Группа –NO 2 в алканах может быть превращена в С=О посредством реакции Нефа или вариантами реакции Мак-Мурри, где под действием TiCl 3 нитроалкан превращается в имин, который затем превращается в имин. гидролизуется в кислой среде до соответствующего карбонильного соединения.
1.1.2.
1,4-кетоэфирные соединения
γ-Кетоэфиры, 1,4-диэфиры и 1,4-дикислоты могут быть отсоединены к природному катиону синтону, синтетическим эквивалентом которого является α,β-ненасыщенное карбонильное соединение, и к неприродному («нелогичному» ) анион синтон (-) COOR, синтетическим эквивалентом которого является цианид-ион.
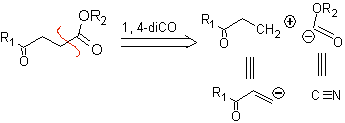
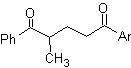
Примеры: Предложите план синтеза из простых и доступных материалов для каждой из следующих молекул:
МОБ 35
| МОБ 36
| |
Моб 37
| Моб 38
|
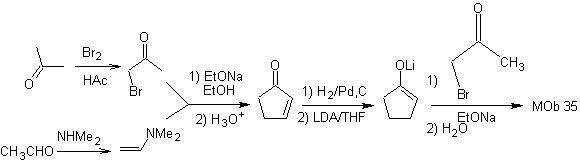
МОБ 35 (а). Ретросинтетический анализ . Молекула может быть разъединена по модели 1,4-диСО. Образовавшийся предшественник циклопентанон должен быть предварительно активирован, чтобы его Cα был более нуклеофильным, а затем использовать в реакции с α-бромацетоном.
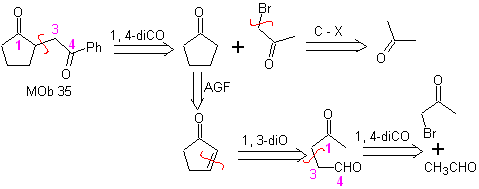 синтез . Нуклеофильность циклопентанона контролируется и гарантируется с помощью LDA, чтобы получить
синтез . Нуклеофильность циклопентанона контролируется и гарантируется с помощью LDA, чтобы получить
- Информация о материале
- Wilbertrivera
- ОРГАНИЧЕСКИЙ СИНТЕЗ
- Просмотров: 21681
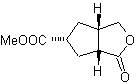
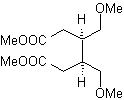
1,6-дифункциональные соединения предпочтительно используют стратегию повторного соединения для их соответствующего синтеза; Эту стратегию можно очень хорошо комбинировать с реакцией Дильса-Альдера, которая обычно дает шестичленные олефиновые аддукты, или с реакцией Берча бензольных колец, которая также дает шестичленные олефиновые продукты.
1.
1,6-диоксигенированные соединения
Реакция образования дикарбонильных соединений в различных возможных сочетаниях: дикетоны, кетокислоты, кетоальдегиды, дикислоты и т. д. и на разном расстоянии друг от друга, несомненно, является реакцией озонолиз олефиновых соединений.
В зависимости от структуры субстрата и условий реакции на образующемся озонидном промежуточном продукте в результате разрыва олефиновой двойной связи будет получено огромное разнообразие соединений. Из них особый интерес представляют те, которые находятся в 1,6-диоксигенированном соотношении, что можно сделать из следующей синтетической операции «пересоединения»:
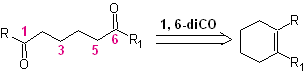
Лучший способ понять работу этой «синтетической операции повторного подключения» — это
будет достигнуто за счет решения синтеза следующих органических молекул:
МОБ 50
| МОБ 51
| МОБ 52
| ||
МОБ 53
| Моб 54
| МОБ 55
|
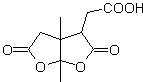
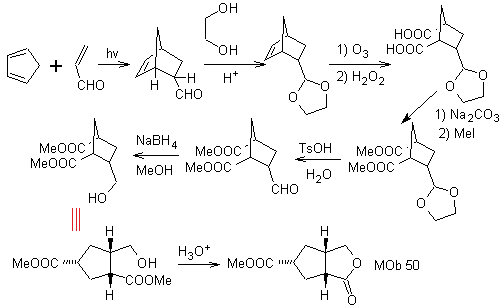
МОБ 50 . Ретросинтетический анализ : в первую очередь это связано с лактонной функцией молекулы . По образовавшейся молекуле-предшественнику, в свою очередь, можно утверждать , что ее образование могло происходить из диакарбоновой кислоты в положении 1-6. Которые повторно соединяются с образованием алкена, который их произвел в результате реакции окислительного озонолиза. Образовавшийся алкен представляет собой типичный аддукт Дильса-Альдера между циклопентадиеном и кротоновым альдегидом.
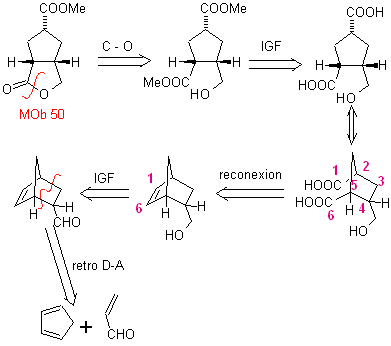
Синтез: реакция Дильса-Альдера между циплопентадиен и α,β-ненасыщенный альдегид обеспечивает алкеновый аддукт для его соответствующего раскрытия окислительным озонолизом перед реакцией защиты альдегидной группы, с которой впоследствии снимают защиту, для восстановления до спиртовой функции. Этот спирт реагирует со сложноэфирной группой в кислой среде с образованием желаемого лактона, MOb 50.
- Информация о материале
- Wilbertrivera
- ОРГАНИЧЕСКИЙ СИНТЕЗ
- Просмотров: 25344
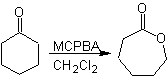
Окисление Байера – Виллигера
Еще одна реакция, которую можно связать со стратегией Ретросинтез представляет собой окисление кетонов пероксикислотами, более известное как реакция Байера-Виллигера. В циклических кетонах при окислении надкислотами образуются лактоны. Группы, присоединенные к асимметричным кетонам, обладают миграционной способностью, что позволяет буквально «вставить атом кислорода» между карбонильной группой и мигрирующей группой, образуя сложный эфир или лактон.
Следует учитывать, что еноны (α, β ненасыщенные кетоны) не являются хорошими субстратами для окисления Байера-Виллигера, так как алкен гораздо более реакционноспособен, чем кетон. Однако Существуют специальные структуры, в которых алкен может быть защищен ближайшим заместителем из-за стерического эффекта и, таким образом, направить атаку надкислоты на карбонильную группу.
| … |
|
Помните, что миграционная способность различных групп в реакции Байера-Виллигера выглядит следующим образом:
H> Ph> 3° алкил> циклоалкил> 2° алкил> 1° алкил> Me
Предложите схему синтеза следующих молекул:
МОБ 56
L-допа | . | Моб 57
| . | МОБ 58
|
МОБ 59
| МОБ 60
| моб 61
|
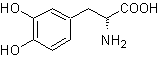
МОБ 56. Ретросинтетический анализ.
Альфа-аминокислота
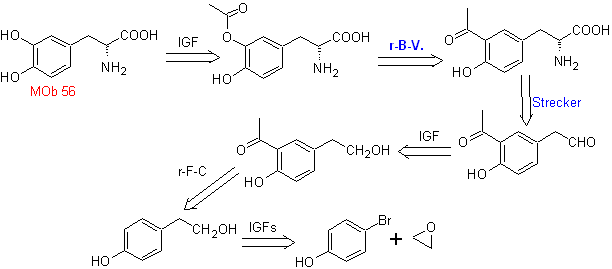
Синтез. Для Для образования необходимого Гриньяра защищают орто-ОН бензола. Синтез Штрекера позволяет получить альфа-аминокислоту, которая окисляется по методу Байера-Виллигера надкислотой и продукт подвергается кислотному гидролизу сложноэфирной группы, что приводит к образованию
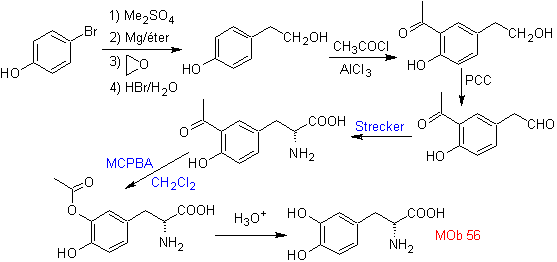
Подробнее: Окисление Байера-Виллигера как стратегия ретросинтеза
- Информация о материале
- Wilbertrivera
- ОРГАНИЧЕСКИЙ СИНТЕЗ
- Просмотров: 29027
Транспозиция Бекмана как стратегия в
Перегруппировка оксимов в кислой среде, называемая перегруппировкой Бекмана, дает амид или лактам, если исходный кетон линейный или циклический соответственно.
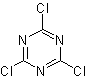
Для повышения производительности этого типа реакции были изучены различные катализаторы и кислые среды. Так, например, новыми кислыми средами, используемыми в качестве катализаторов с указанной целью, являются: ТХТ/ДМФА, ДАСТ/СН 2 CL 2 , CF 3 SO 3 H, PCl 5 , HgCl 2 /MeCN. и ZnO.
ТСТ: трихлортриазин | …… | ДАСТ: диэтиламиносульфид трифторид |
Миграционная приспособленность групп такая же, как и в реакции Байера-Виллигера. Предложите схему синтеза каждой из следующих молекул:
Моб 62 | моб 63 | МОБ 64 |
МОБ 62 . Ретросинтетический анализ.
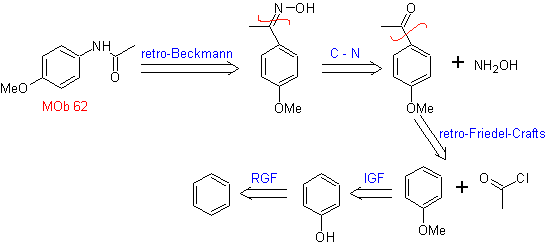
Синтез. Реакция промежуточного ароматического кетона с NH 2 OH и его последующая обработка водным раствором серной кислоты и ZnO позволяет получить ароматический амид MOb 62.
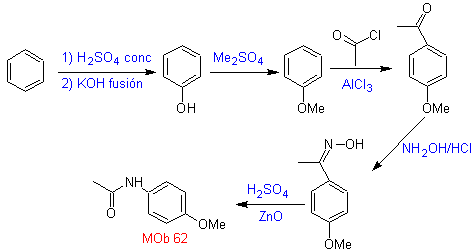
Подробнее: Перегруппировка Бекмана как стратегия ретросинтеза
- Информация о материале
- Wilbertrivera
- ОРГАНИЧЕСКИЙ СИНТЕЗ
- Просмотров: 21055
Другие стратегии синтеза, использующие «нелогичные» синтоны
1.
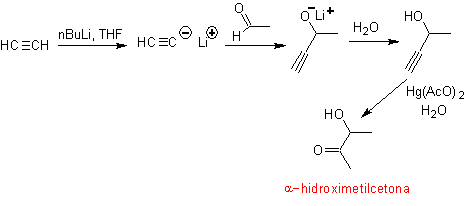
присоединение тройной связи
Стратегия «добавления» тройной связи между двумя оксигенированными функциями в положении 1,4 позволяет позже работать с разъединением на основе химии ацетилидов. Чтобы проиллюстрировать эту стратегию, давайте посмотрим на разработку плана синтеза для
Моб. 40. Ретросинтетический анализ . Первый ИФР в
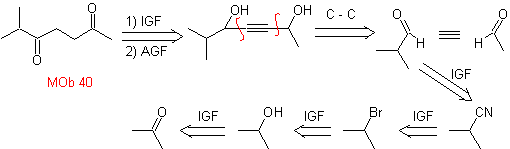
Синтез. Диацетилид или ацетилид поэтапно соединяется с молекулами различных альдегидов, образующуюся промежуточную молекулу гидрируют, а затем ее спирты окисляют до дикетонового соединения Моб 40.
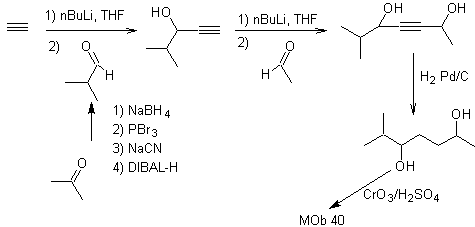
γ-лактоны также могут быть получены аналогичным образом, как показано ниже:

2.
Добавление группы COOR в качестве группы активации
Добавление группы COOR, помимо активации синтона аниона, способствует отсоединению молекулы 1,4-диХ.
синтезировать |
|
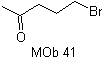
MOb 41. Ретросинтетический анализ.
Подробнее: Другие стратегии синтеза, в которых используются «нелогичные» синтоны.
- Информация о материале
- Wilbertrivera
- ОРГАНИЧЕСКИЙ СИНТЕЗ
- Просмотров: 50401
СИНТЕЗ АРОМАТИЧЕСКИХ СОЕДИНЕНИЙ I
(метод дерева синтеза)
Предложите план синтеза, используя толуол или ксилол в качестве исходных материалов, для следующих молекул:
(Моб 12)
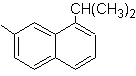
1-изопропил-7-метилнафталин | (Моб 13)
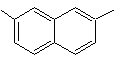
2,7-диметилнафталин |
(Моб 14)
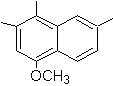
1-изопропил-6-метилнафталин | (Моб 15)
4-метокс-1,2,7-триметилнафталин |
Решение: (MOb 12).
В предполагаемой стратегии учитывается, что последняя стадия может реагировать на процесс «ароматизации», для которого предполагается, что молекула предшественника представляет собой неароматическое кольцо с двойной связью.
на углероде, содержащем двойную связь и алкильную группу.
Эта структура может быть получена действием Гриньяра на карбонил и последующей дегидратацией образовавшегося спирта. Кетон образуется путем ацилирования соответствующего бензольного соединения янтарным ангидридом и его последующего внутримолекулярного ацилирования Фриделя-Крафтса.
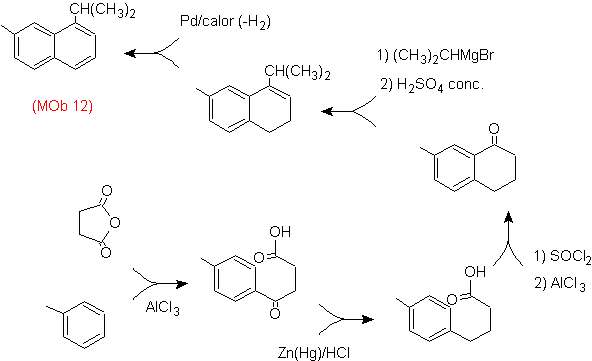
Решение (MOb 13).
Опять же, молекула-предшественник должна быть «ароматизирована», что является наиболее подходящей стратегией среди других. Он основан на сочетании ацилирования замещенным янтарным ангидридом и восстановления Клемменсена.
Конечный карбонил восстанавливается до спирта, который затем дегидратируется молекулярным водородом и катализатором, называемым хромилом меди.
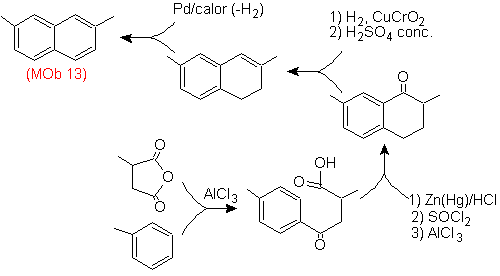
- Информация о материале
- Wilbertrivera
- ОРГАНИЧЕСКИЙ СИНТЕЗ
- Просмотров: 29256
СИНТЕЗ АРОМАТИЧЕСКИХ СОЕДИНЕНИЙ II
(метод дерева синтеза)
Хотя одной из первых проблем, которые необходимо решить при синтезе полизамещенных ароматических соединений, является контроль ориентационных эффектов и образования нежелательных изомеров, важно также изучить реакционную способность аренов, поскольку в какой-то момент В смысле присутствия алифатических групп в ароматическом соединении они во многих случаях проявляют характеристики и реакционную способность, типичные для типа органического соединения, к которому они принадлежат, и те, которые являются результатом взаимодействия алифатических и ароматических групп.
На этой цели основано, синтез молекул №20-27, на этот раз из указанных материалов, поэтому вопрос ставится так: какие реакции Обоснуйте следующие преобразования?
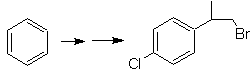
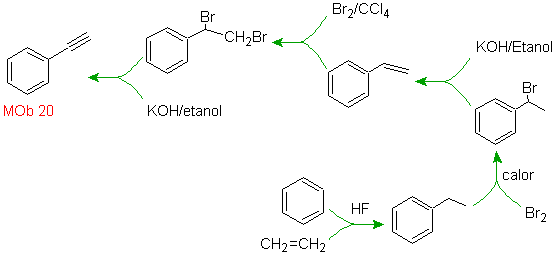
Моб 20 решение.
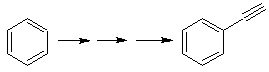
Мы знаем, что ион ацетилида не может действовать непосредственно на бензол, поэтому тройная связь получается из алкильной группы
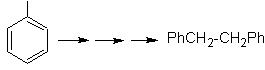
век-дибром, который получают бромированием стирола, ранее полученного дегидробромированием бензилгалогенида, образованного бромированием по свободнорадикальному механизму на этилбензоле
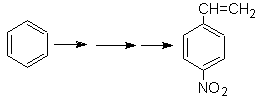
Решение Моб 21.
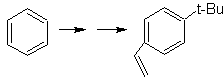
Пара-нитростирол не может быть получен прямым нитрованием стирола, так как этенильная группа, присоединенная к кольцу, неустойчива в условиях нитрования.
Таким образом, молекула предшественника будет иметь группу, которую легко дегидробромировать. Этот предшественник получают радикальным бромированием этильной группы, связанной с бензольным кольцом, которое ранее нитровали преимущественно в пара-положении.
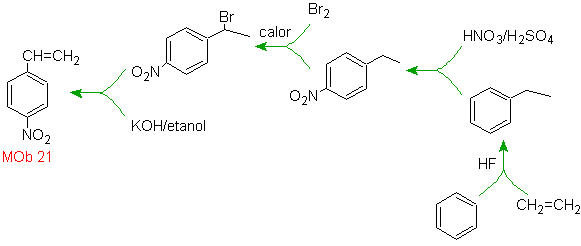
- Информация о материале
- Wilbertrivera
- ОРГАНИЧЕСКИЙ СИНТЕЗ
- Просмотров: 32057
СИНТЕЗ АЛКОГОЛЬ
(метод дерева синтеза)
Предложите план синтеза указанных молекул-мишеней из указанных одиночных молекул (MOb 30-41). Для этого используйте реагенты и условия реакции, которые считаете необходимыми:
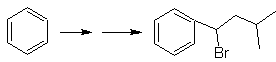
раствор МОБ 30.
Стратегия: наблюдается, что исходная молекула обезвожена и в первоначально незамещенном аллильном положении водород замещен циано- или нитрильной группой. Эта последняя реакция может происходить только в том случае, если молекула-предшественник представляет собой аллилгалогенид, поэтому она предлагается в качестве предшественника
Br вводится в желаемое положение с NBS, а алкен является продуктом дегидратации исходной молекулы.
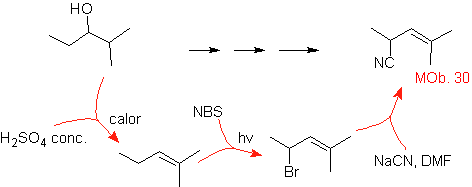
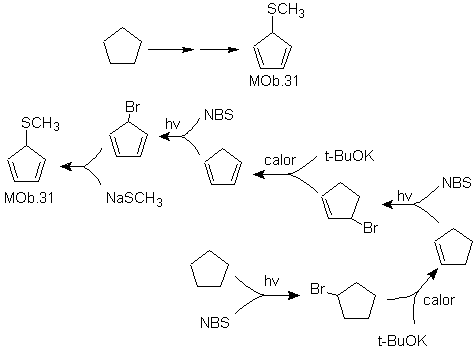
Решение МОБ 31.
Стратегия : Это родственный эфир, необходимой молекулой-предшественником будет 1,3-циклопентадиенгалогенид.
Этот галогенид получают действием NBS на диеновый циклоалкен, который, в свою очередь, получают дегидробромированием молекулы-предшественника, что достигается действием NBS на образовавшийся циклоалкен. предварительно дегидрогалогенированием исходной молекулы, бромированной радикалами
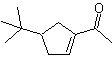
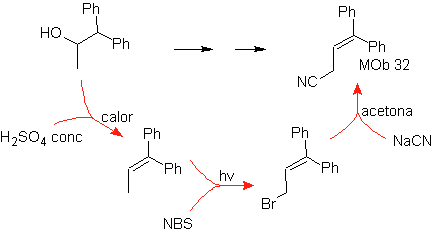
Моб 32 решение.
Стратегия : аналогична той, что используется для получения
- Информация о материале
- Wilbertrivera
- ОРГАНИЧЕСКИЙ СИНТЕЗ
- Просмотров: 24942
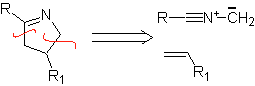
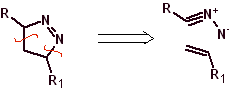
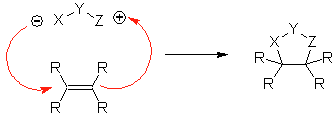
В этих реакциях обычно образуются пятичленные гетероциклические кольца, для которых необходима реакция между диполярным соединением n1,3 и алкеном. Реакция представляет собой [3-2] циклоприсоединение. 1,3-диполярные соединения, которые чаще всего использовались для образования пентагональных гетероциклов:
 |  |
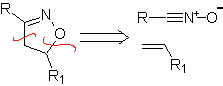 | 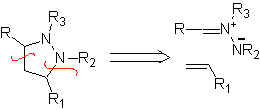 |
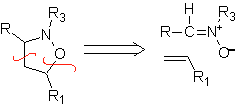 | 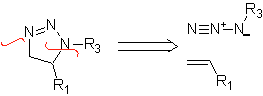 |
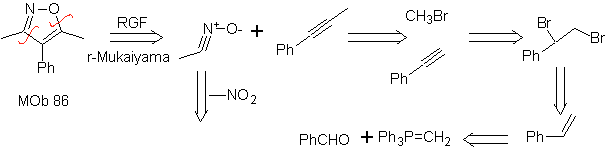
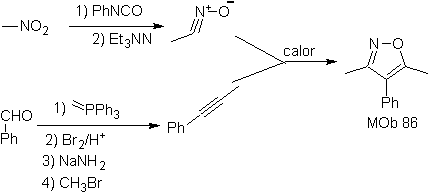
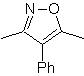
| Моб: 86
| . | Моб: 87 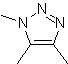 | .. | Моб: 88 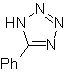 |