I composti 1,6-difunzionalizzati utilizzano preferibilmente la strategia di riconnessione per la loro rispettiva sintesi; Questa strategia può benissimo essere combinata con la reazione di Diels-Alder, che generalmente produce addotti olefinici a sei membri, o la riduzione di Birch degli anelli benzenici, che genera anch'essa prodotti olefinici a sei membri.
1.
Composti 1,6-diossigenati
La reazione che genera composti dicarbonilici, di diverse possibili combinazioni: dichetoni, chetoacidi, chetoaldeidi, diacidi, ecc. e a diverse distanze tra loro, è senza dubbio la reazione di ozonolisi dei composti olefinici.
A seconda della struttura del substrato e delle condizioni di reazione sull'intermedio di ozonuro formatosi, si otterrà un'enorme diversità di composti come risultato della scissione del doppio legame olefinico. Di questi, quelli che sono in un rapporto 1,6 – diossigenato sono di particolare interesse, come si può dedurre dalla seguente operazione sintetica di “riconnessione”:
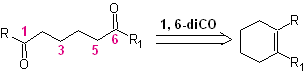
Il modo migliore per comprendere il funzionamento di questa "operazione di riconnessione sintetica" è
sarà ottenuto attraverso la soluzione della sintesi delle seguenti molecole organiche:
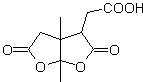
MOb 50
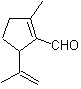
| MOb 51
| MOb 52
| ||
MOb 53
| MOb 54
| MOb 55
|
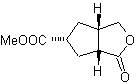
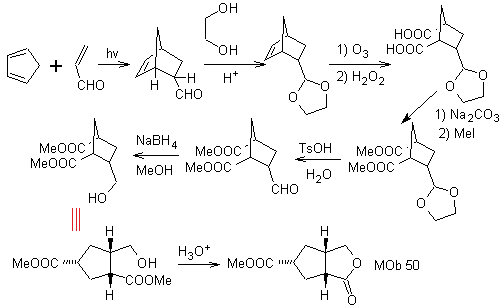
MOb 50 . Analisi retrosintetica : in primo luogo è disconnessa dalla funzione lattone della molecola. Sulla molecola precursore generata, a sua volta, si può sostenere che la sua formazione potrebbe essere avvenuta dall'acido diacarbossilico in posizione 1-6. Che vengono ricollegati per dare origine all'alchene che li ha prodotti per reazione di ozonolisi ossidativa. L'alchene formatosi è un tipico addotto Diels-Alder tra ciclopentadiene e crotonaldeide.
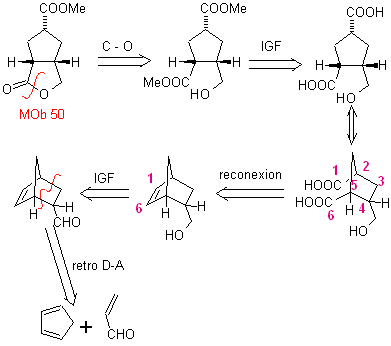
Sintesi: La reazione di Diels-Alder tra ciplopentadiene e l'aldeide α,β-insatura fornisce l'addotto alchenico, per la sua corrispondente apertura per ozonolisi ossidativa, prima di una reazione di protezione del gruppo aldeidico, che viene successivamente deprotetto, da ridurre alla funzione alcolica. Questo alcol reagisce con il gruppo estere in un mezzo acido per formare il lattone desiderato, MOb 50
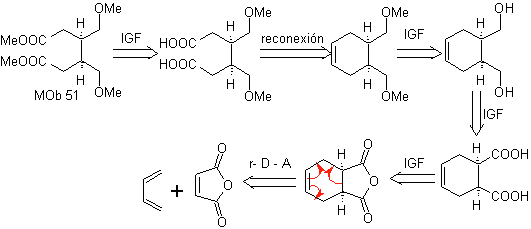
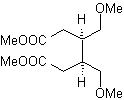
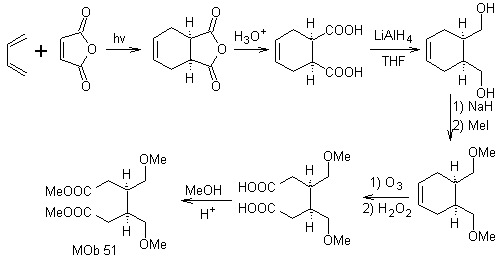
Sintesi. Con la reazione di Diels-Alder si forma l'addotto dell'anidride ciclica che dopo essere stata idrolizzata si riduce al rispettivo alcool, che per Williamson viene trasformato in eteri. Il cicloesene viene aperto dall'ozonolisi ossidativa e i gruppi acidi reagiscono in ambiente acido con l'alcool metilico per trasformarsi in
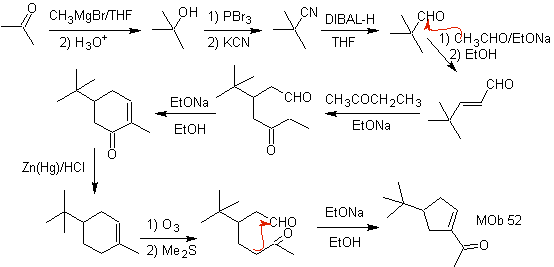
MOb 52 . Analisi retrosintetica: inizialmente disconnessa
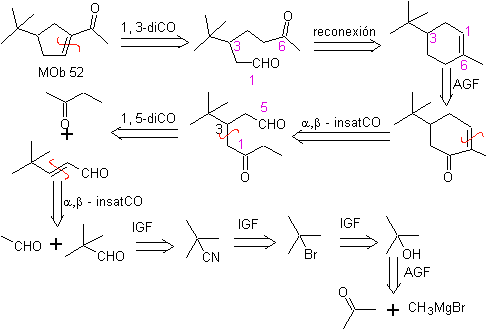
Sintesi : l'acetone permette la formazione dell'intermedio t-butilformaldeide, che in un mezzo basico ed etanolo si condensa con l'etanale. Al prodotto formato α,β-insat CO, si aggiunge il butanone enolato, lo stesso mezzo basico permette la ciclizzazione intramolecolare. Quindi il C=O si trasforma in –CH2, per riduzione. Il cicloalchene prodotto viene aperto per ozonolisi in Me 2 S. E viene nuovamente ciclizzato in un mezzo basico per ottenere
MOb 53 . Analisi retrosintetica: inizia con la disconnessione simultanea dei lattoni da
Il butanone è invece preparato da un acetilene terminale e quest'ultimo da un alogenuro di etile e acetilene di sodio.
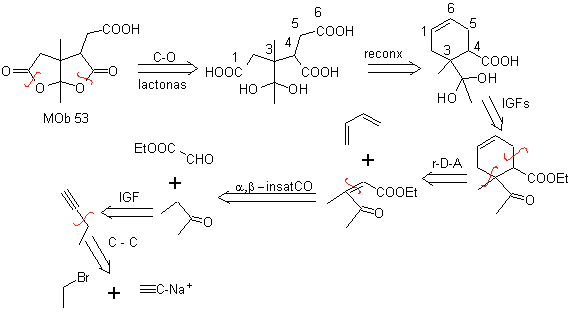
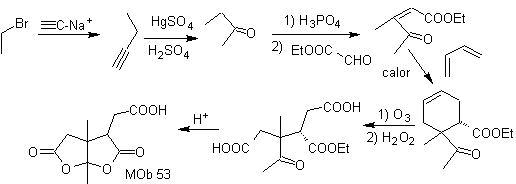
Sintesi. Dopo l'apertura del cicloesene, per ozonolisi ossidativa, L'idrolisi acida del rimanente gruppo estere e la corrispondente formazione del chetone idrato è sufficiente per la formazione dei lattoni e la rispettiva chiusura del ciclo, per produrre
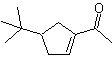
MOb 54 . Analisi retrosintetica : La disconnessione dal doppio legame di
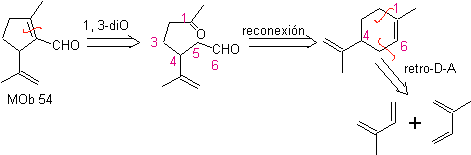
Sintesi: La reazione di Diels-Alder tra due molecole di 2-metil butadiene forma un addotto che con HMCPBA forma un epossido con il centro più reattivo.
·
Per idrolisi acida dell'epossido si forma un diolo che viene ossidato dall'acido. periodico, verso un composto 1,6-diCO Il gruppo CHO viene protetto con un'enammina, mentre si attiva il suo C alfa, per una condensazione in ambiente acido, si riscalda il sistema e si ottiene
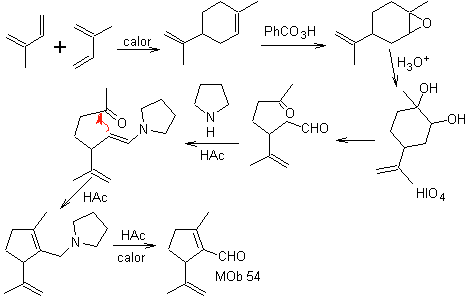
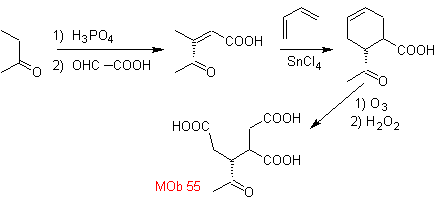
MOb 55. Analisi retrosintetica : la sintesi di
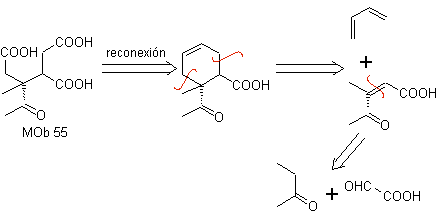
Sintesi. Le reazioni indicate sono già state studiate nella sintesi di