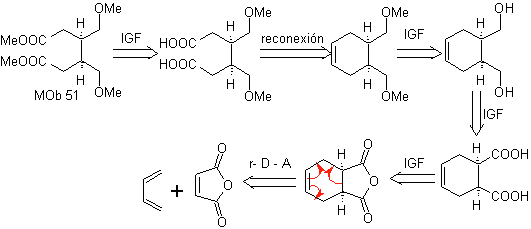
Os compostos 1,6-difuncionalizados utilizam preferencialmente a estratégia de reconexão para suas respectivas sínteses; Essa estratégia pode muito bem ser combinada com a reação de Diels-Alder, que geralmente produz adutos olefínicos de seis membros, ou a redução de anéis de benzeno de Birch, que também gera produtos olefínicos de seis membros.
1.
compostos 1,6-dioxigenados
A reação que gera compostos dicarbonílicos, de diferentes combinações possíveis: dicetonas, cetoácidos, cetoaldeídos, diácidos, etc. e a diferentes distâncias entre si, é sem dúvida a reação de ozonólise de compostos olefínicos.
Dependendo da estrutura do substrato e das condições de reação no intermediário ozonídico formado, uma enorme diversidade de compostos será obtida como resultado da clivagem da dupla ligação olefínica. Destas, as que estão na proporção 1,6 – dioxigenadas são de especial interesse, como se pode inferir da seguinte operação sintética de “religação”:
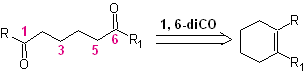
A melhor maneira de entender o funcionamento dessa "operação de reconexão sintética" é
será alcançado através da solução da síntese das seguintes moléculas orgânicas:
MOb 50
| MOb 51
| MOb 52
| ||
MOb 53
| MOb 54
| MOb 55
|
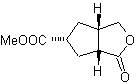
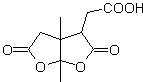
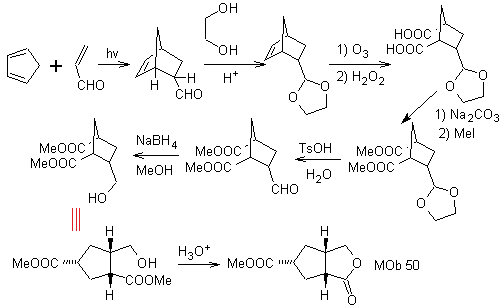
MOb 50 . Análise retrossintética : Em primeiro lugar, é desconectado pela função lactona da molécula. Já na molécula precursora gerada, pode -se argumentar que sua formação pode ter ocorrido a partir do ácido diacarboxílico na posição 1-6. Que são reconectados para dar origem ao alceno que os produziu pela reação de ozonólise oxidativa. O alceno formado é um típico aduto de Diels-Alder entre o ciclopentadieno e o crotonaldeído.
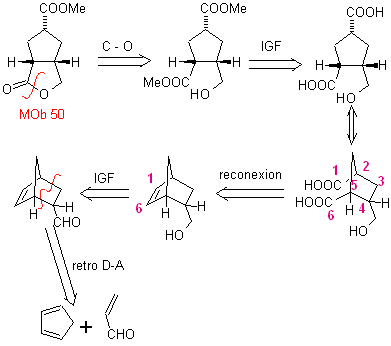
Síntese: A reação de Diels-Alder entre ciplopentadieno e o aldeído α,β-insaturado fornece o aduto alceno, para sua correspondente abertura por ozonólise oxidativa, antes de uma reação de proteção do grupo aldeído, que posteriormente é desprotegido, para ser reduzido à função álcool. Este álcool reage com o grupo éster em meio ácido para formar a lactona desejada, MOb 50
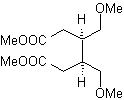
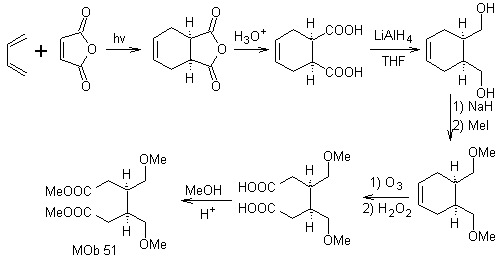
Síntese. Com a reação de Diels-Alder, forma-se o aduto anidrido cíclico, que após ser hidrolisado é reduzido ao respectivo álcool, que por Williamson é transformado em éteres. O ciclohexeno é aberto por ozonólise oxidativa e os grupos ácidos reagem em meio ácido com o álcool metílico para se transformar em
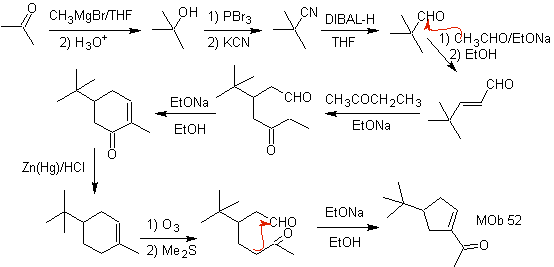
MOb 52 . Análise retrossintética: Inicialmente desconectado
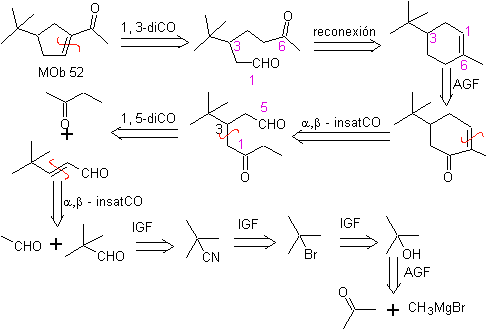
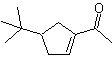
Síntese : A acetona permite a formação do intermediário t-butilformaldeído, que em meio básico e etanol se condensa com etanal. Ao produto formado, α,β-insat CO, adiciona-se o enolato de butanona, o mesmo meio básico permite a ciclização intramolecular. Então o C=O é transformado em –CH2, por redução. O cicloalceno produzido é aberto por ozonólise em Me 2 S. E é novamente ciclizado em meio básico para obter
MOb 53 . Análise retrossintética: começa com a desconexão simultânea das lactonas de
Por outro lado, o butanona é preparado a partir de um acetileno terminal e este último a partir de um haleto de etila e acetileno sódico.
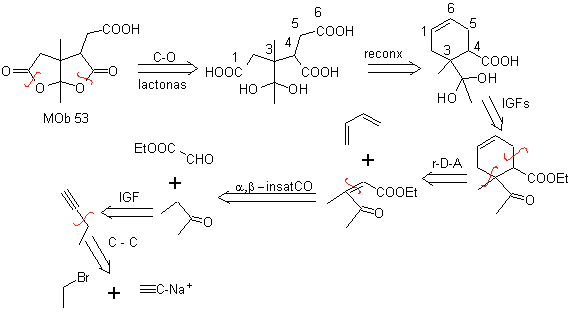
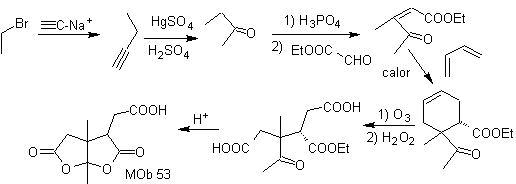
Síntese. Após a abertura do ciclohexeno, por ozonólise oxidativa, A hidrólise ácida do restante grupo éster e a correspondente formação do hidrato de cetona é suficiente para a formação das lactonas e respectivo fechamento do ciclo, para produzir
MOb 54 . Análise retrossintética : A desconexão pela ligação dupla de
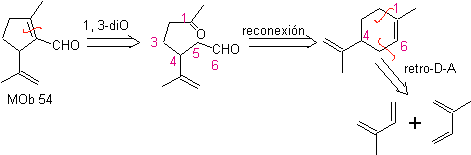
Síntese: A reação de Diels-Alder entre duas moléculas de 2-metil butadieno forma um aduto que com HMCPBA forma um epóxido com o centro mais reativo.
·
Na hidrólise ácida do epóxido forma-se um diol que é oxidado pelo ácido. periódico, em direção a um composto 1,6-diCO. O grupo CHO é protegido com uma enamina, enquanto ativa seu C alfa, para uma condensação em meio ácido, o sistema é aquecido e obtemos
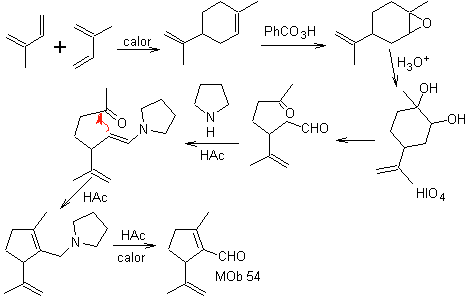
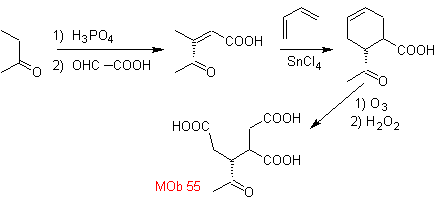
MOb 55. Análise retrossintética : A síntese de
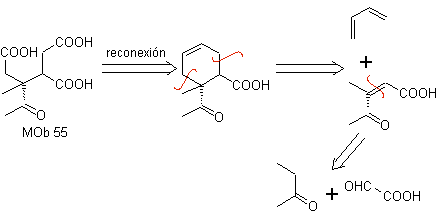
Síntese. As reações indicadas já foram estudadas na síntese de