O controle na síntese orgânica é uma das tarefas mais importantes para alcançar a transformação necessária ou planejada. e/ou evitar a formação daqueles subprodutos que prejudicam substancialmente o desenvolvimento ideal da síntese orgânica em questão. Da mesma forma, em uma perspectiva mais geral, o controle também pode incluir ou abranger os aspectos de simetria e seletividade.
Então, o controle deve ser entendido como uma série de operações sintéticas que permitem ao químico formar o esqueleto de carbono com a funcionalidade pretendida ou "colocar" um grupo ou átomo no local ou posição necessária.
Consequentemente, essas operações podem ser de uma gama variada de rotinas com uma intenção refletida pelo químico e que exigem certas habilidades cognitivas e habilidades semelhantes às artísticas, para a construção (síntese) de moléculas orgânicas.
Portanto, nas reações de condensação, como em outras, as operações de controle podem ser incluídas em uma das seguintes categorias.
![]() Reações competitivas (autocondensação e/ou condensação cruzada)
Reações competitivas (autocondensação e/ou condensação cruzada)
![]() Ativação – desativação
Ativação – desativação
![]() Seletividade e especificidade
Seletividade e especificidade
![]() Proteção-desproteção
Proteção-desproteção
Nas reações de condensação de compostos carbonílicos, é essencial estabelecer previamente a ordem dos eventos para minimizar ou, se necessário, suprimir as possibilidades de autocondensação e a ocorrência de condensação cruzada, que infelizmente são uma ameaça evidente nessas reações. .
autocondensação
Todos os compostos carbonílicos que possuem um ou mais hidrogênios alfa, nos carbonos adjacentes ao grupo carbonílico, correm o risco de sofrer uma reação de autocondensação se o rigor correspondente não for seguido.
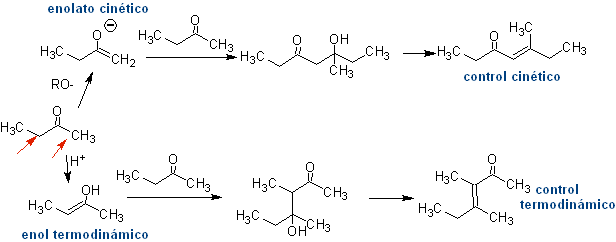
Assim, por exemplo, se uma base não hidroxilada como a EtONa for adicionada a uma 2-butanona, forma-se um enolato que pode eventualmente combinar-se com outra molécula da mesma cetona. Da mesma forma, se H+ for adicionado, a autocondensação também pode ocorrer, como pode ser visto no esquema a seguir: Isso pode ser minimizado adicionando na mesma taxa, de alimentadores separados, a base ou ácido ao composto que fornecerá o enol ou enolato e o composto carbonílico que será atacado no carbono carbonílico . Um balão de três tubuladuras e agitação magnética podem ser usados.
condensação cruzada
Idealmente, em reações de condensação de compostos carbonílicos, uma das moléculas reagentes deve enolizar rapidamente, enquanto a outra deve preferencialmente não ter Hα. , para garantir que nenhum outro subproduto seja formado
A retrossíntese que se analisa a seguir é um bom exemplo do que foi indicado anteriormente.
Condensação intramolecular .
Quando há dois grupos funcionais em uma molécula que afetam diretamente os carbonos alfa em relação à carbonila, o mais provável é que haja uma autocondensação intramolecular e os ciclos que se formam devem ter alta estabilidade, como é o caso dos anéis de cinco e seis links. Anéis com maior número de elos bifuncionalizados (7, 8 etc.), não são prováveis produtos devido à labilidade destes ciclos.
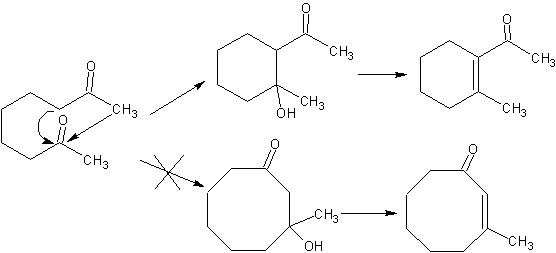
Usando a reação de Mannich.
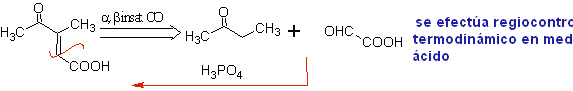
Nas reações de adição conjugada em substratos de carbonila alfa, beta-insaturada ( α, β-inssatCO), característica da reação de Michael, surge a necessidade de utilizar vinilcetonas. Mas quando se tenta preparar a partir da condensação da cetona e do formaldeído, formam-se outros produtos de polimerização do aldeído que dificultam sua preparação.
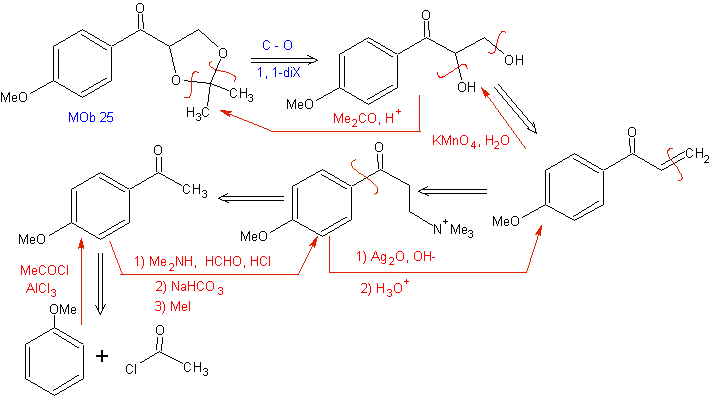
A reação de Mannich permite obter vinilcetonas durante a síntese e no momento necessário, o que por outro lado apresenta sérias dificuldades em sua preparação. Este aspecto é ilustrado na síntese de MOb 25
Ativação dos grupos
Sistema não ativado:
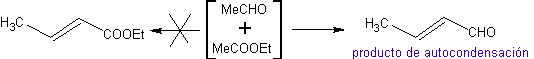
sistema ativado
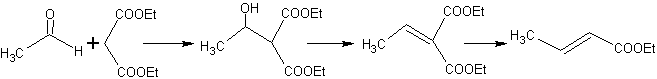
¨ enamina
Já foi dito que uma das formas de se ter um enolato ativado é a formação de uma enamina, entre o composto carbonílico e uma amina secundária. Este aspecto é mostrado no seguinte exemplo de síntese.
Análise retrossintética: Na síntese do MOb 26 observa-se o uso adequado de enaminas para garantir a formação do composto 1,3 diCO.
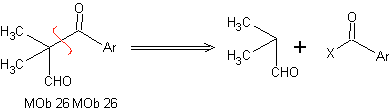
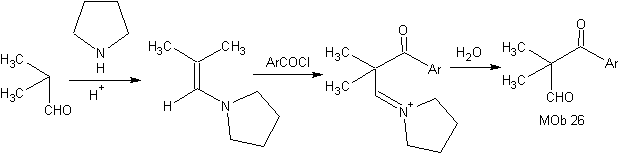
Síntese: A enamina formada, permite sua respectiva acilação, para chegar ao Mob26
¨ redução de bétula
Essa redução constitui uma boa alternativa para preparar ciclohexenonas, como pode ser visto na síntese do MOb 27:
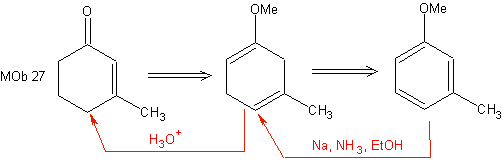
No entanto, deve ser lembrado que certos compostos α, β -carbonil insaturado, também pode ser preparado pela reação de Wittig e pela reação de Reformatsky.
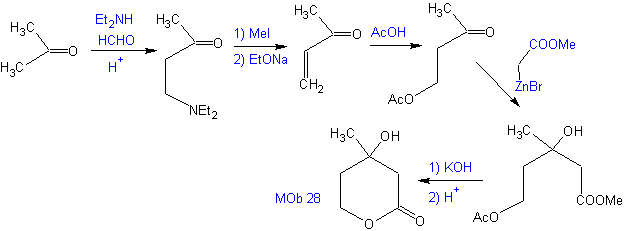
Proponha um plano de síntese, a partir de materiais simples para MOb 28.
Análise retrossintética: Inicialmente a lactona é desconectada, seguida pela desconexão como um padrão de 1,3-diO. O composto carbonílico α,β-insaturado (α,β- insat. CO) gerado pode ter sido obtido pela eliminação de Hoffmann e a cetoamina, pela reação de Mannich
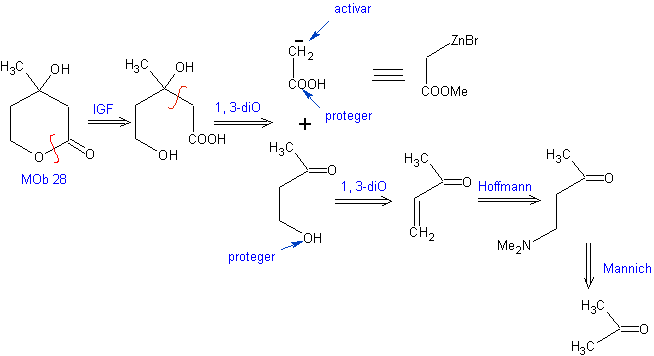
Síntese: O síntese de Mob 28, é muito apropriado para mostrar o controle que deve ser exercido sobre determinados centros de reação para alcançar as transformações desejadas e necessárias.