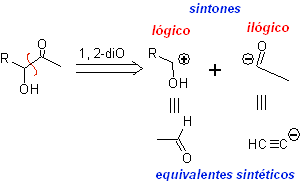
Os compostos α-hidroxicarbonila são desconectados na ligação CC que une as duas funções. Esta operação leva a um sínton natural ou lógico (o sínton catiônico) e a um sínton não natural ou ilógico (o sínton aniônico). Os equivalentes sintéticos podem ser aldeídos e íon acetileto, respectivamente.
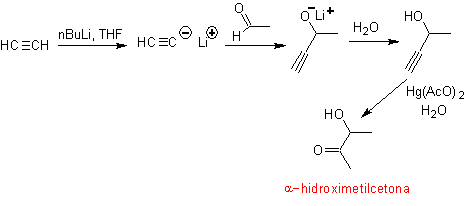
O grupo acetileno terminal com sais de mercúrio em meio ácido forma uma metilcetona. Esta reação também é útil se o grupo acetileno for interno e também simétrico.
Um caso especial de α-hidroxicetonas são benzoínas ou diarilhidroxicetonas , onde os dois grupos R são aromáticos ou heterociclos. Os benzoins são o resultado da autocondensação do benzaldeído catalisada por íons cianeto.
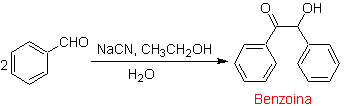
As benzoínas podem não ser simétricas, por exemplo, um dos aldeídos pode ser um aldeído de piridina. O íon cianeto não catalisa aldeídos alifáticos, que sofrem o mesmo acoplamento na presença de sais de tiazólio.
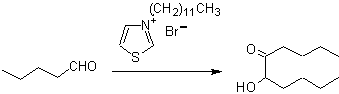
As α-hidroxicetonas alifáticas podem ser formadas a partir da condensação de ésteres carboxílicos com sódio metálico em um solvente inerte e sob refluxo. Essas hidroxicetonas são chamadas de aciloínas e as reações de condensação podem ocorrer intramolecularmente e intermolecularmente.
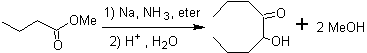

Os compostos agrupados sob o nome de ácidos oxocarboxílicos , que incluem aldeídos e cetoácidos, são de grande importância na série alifática e tanto por sua relação bioquímica com os oxácidos, quanto pelas reações de síntese que podem ocorrer a partir deles ou a partir deles. Seus derivados constituem um importante grupo de compostos orgânicos, sobre o qual intenso trabalho vem sendo feito nos últimos tempos.
2.- Compostos 1,2-Dióis Os 1,2-dióis têm nas olefinas os melhores precursores para a sua preparação, dependerá apenas da estereoquímica do diol em questão, recorrer a uma das reações específicas resumidas na tabela anexa.
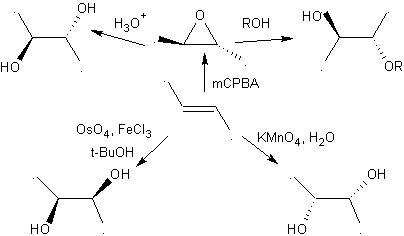
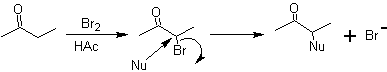
Moléculas 1,2-dioxigenadas também podem ser construídas usando eletrófilos ilógicos; Os reagentes mais importantes deste tipo são os compostos carbonílicos alfa-halogenados obtidos por halogenação da forma enol de um composto carbonílico.
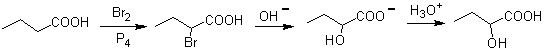
Outro método que produz compostos 1,2-difuncionalizados consiste na clivagem oxidativa de ligações duplas pelo ozônio para gerar duas carbonilas, que irão variar de acordo com as condições da reação.
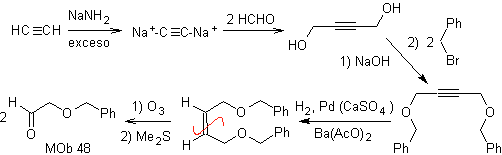
| Turma 48:
|
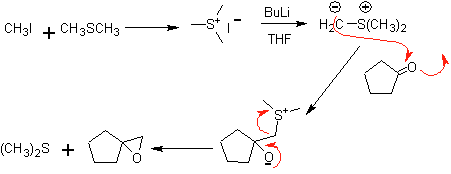
Análise retrossintética. a máfia 48 é um éter olefínico assimétrico e com o grupo aldeído em uma extremidade, razão pela qual pode-se supor que seja o resultado da abertura de uma ligação dupla por ozonólise seguida da reação com Me 2 S. A dupla ligação do precursor é funcionalizada em um alcino interno etéreo simétrico.
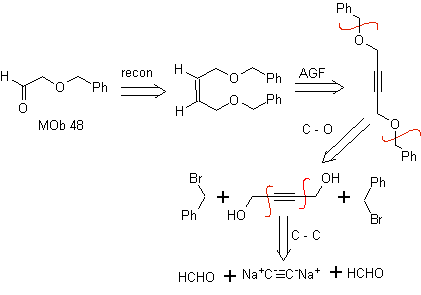
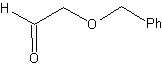
Os éteres são o resultado da aplicação da síntese de Williamson e do diol da reação do diacetilido sobre aldeídos, como material de partida.
síntese . O diacetilido é feito com excesso de sodamida, que age sem formaldeído, para dar o álcool, que é eterificado por Williamson. O alcino é reduzido a um alceno que é aberto por ozonólise, seguida de reação com Me 2 S para formar o aldeído.
síntese . O diacetilido é feito com excesso de sodamida, que age sem formaldeído, para dar o álcool, que é eterificado por Williamson. O alcino é reduzido a um alceno que é aberto por ozonólise, seguida de reação com Me 2 S para formar o aldeído.