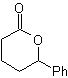
Oxidação de Baeyer-Villiger
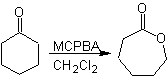
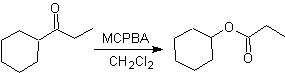
Outra reação que pode ser associada à estratégia do A retrossíntese é a oxidação de cetonas por peroxiácidos, mais conhecida como reação de Baeyer-Villiger. Nas cetonas cíclicas, a oxidação com perácidos gera lactonas. Os grupos ligados às cetonas assimétricas têm uma capacidade migratória, o que permite, em termos literais, "inserir um átomo de oxigênio" entre o grupo carbonila e o grupo migratório, produzindo assim um éster ou uma lactona.
Deve-se levar em conta que as enonas (α, β cetonas insaturadas) não são bons substratos para a oxidação Baeyer-Villiger, pois o alceno é muito mais reativo que a cetona. Porém Existem estruturas especiais onde o alceno pode ser protegido por um substituinte próximo devido ao efeito estérico e assim direcionar o ataque do perácido para o grupo carbonila.
| … |
|
Lembre-se que a aptidão migratória dos diferentes grupos, na reação de Baeyer-Villiger, é a seguinte:
H> Ph> 3º alquil> cicloalquil> 2º alquil> 1º alquil> Me
Proponha um plano de síntese para as seguintes moléculas:
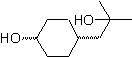
MOb 56
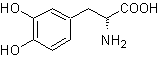
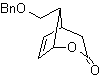
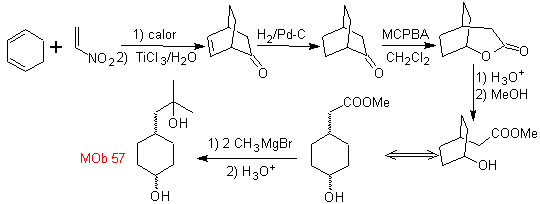
L-Dopa | . | MOb 57
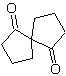
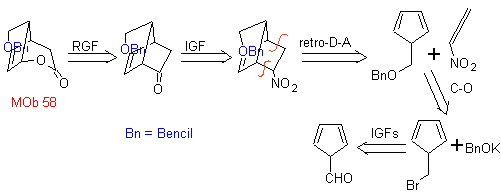
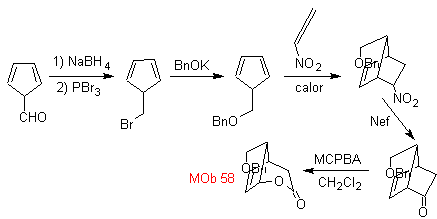
| . | MOb 58
|
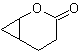
MOb 59
| MOb 60
| multidão 61
|
MOb 56. Análise retrossintética.
O alfa aminoácido
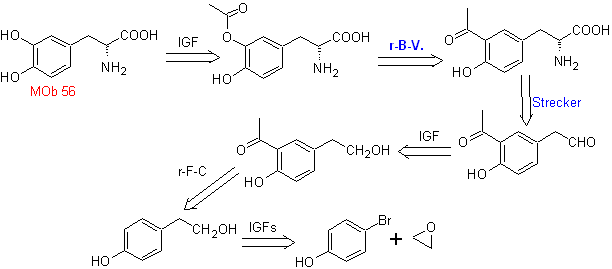
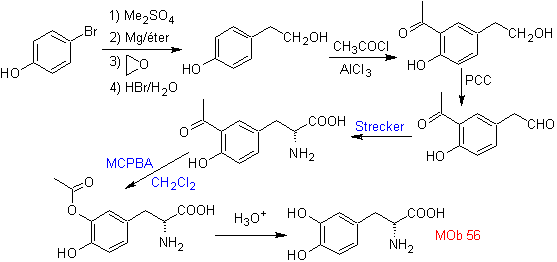
Síntese. Para Para a formação do Grignard requerido, o orto OH do benzeno é protegido. A síntese de Strecker permite a formação do aminoácido alfa, que é oxidado segundo Baeyer-Villiger com um perácido e o produto sofre hidrólise ácida do grupo éster, o que leva à formação de
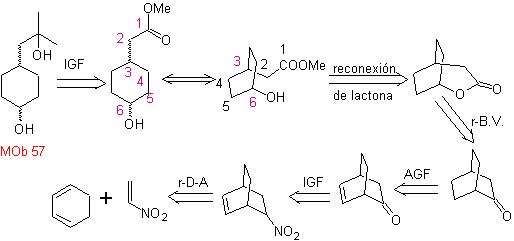
síntese . Começa a partir da reação de Diels-Alder de um ciclohexadieno e um nitroetileno. O aduto formado é saturado, para proceder à oxidação Baeyer-Villiger. A abertura da lactona e esterificação do grupo ácido, forma um intermediário que é então tratado com excesso de brometo de metil magnésio, para obter
MOb 58. Análise retrossintética. A ligação dupla conjugada a um grupo C=O, presente em
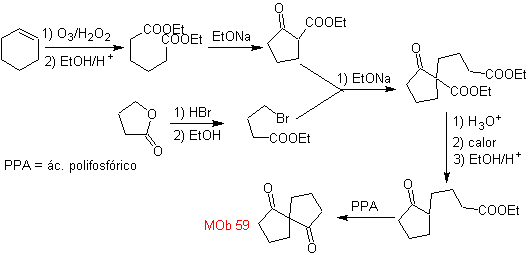
MOb 59 . Análise retrossintética. Ele continua a desconectar
Mais uma vez, é gerado um 1,3-diCO intermediário ou precursor que, ao ser desconectado, gera uma nova estrutura de 1,6-diCO, que agora pode ser reconectada para obter o cicloexeno como material de partida.
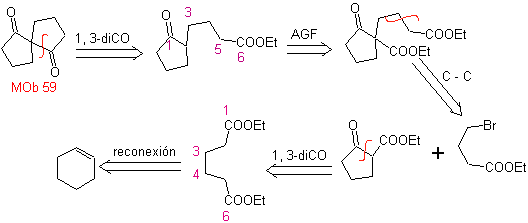
síntese . A abertura oxidativa de um ciclohexeno permite obter a molécula precursora que, após reagir com o γ-bromoéster, dá origem a uma molécula que, após uma reação de Dieckmann, é facilmente transformada em
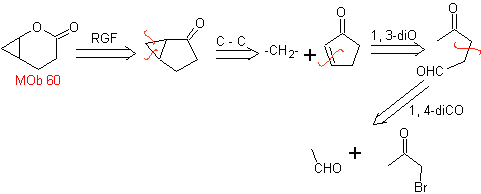
MOb 60 . Análise retrossintética. Supõe-se que a formação de
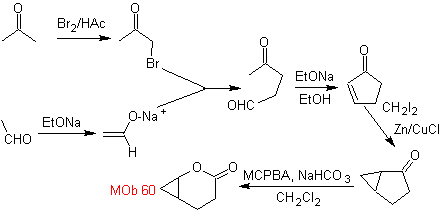
síntese . O enolato de acetaldeído combina com α-bromocetona para formar uma molécula de 1,4-diCO, que em meio básico e EtOH condensa com desidratação para formar uma ciclopentanona α,β-insaturada. A reação de Simonns-Schmidt continua a formar ciclopropano e uma subsequente oxidação do mesmo de acordo com Baeyer-Villiger produz
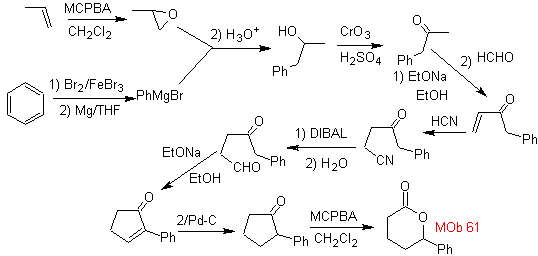
MOb 61 . Análise retrossintética . É assumido que
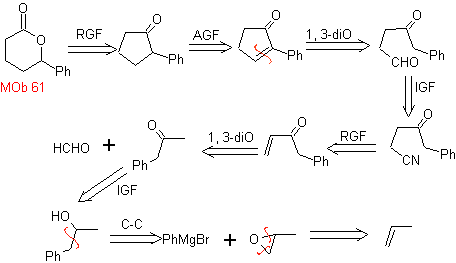
Síntese. Propeno e benzeno são tomados como materiais de partida, a estratégia é reduzir o nitrilo a CHO com DIBAL em hexano, para formar o intermediário que por anulação de Robinson (ou anulação) e posterior saturação, fornece a ciclopentanona adequada para ser oxidada pelo Baeyer- procedimento de Villiger, para formar