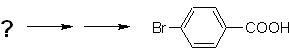SÍNTESE DE COMPOSTOS AROMÁTICOS I
(Método da Árvore de Síntese)
Proponha um plano de síntese, usando tolueno ou xileno como materiais de partida, para as seguintes moléculas:
(MOb 12)
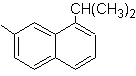
1-isopropil-7-metilnaftaleno | (MOb 13)
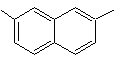
2,7-dimetilnaftaleno |
(MOb 14)
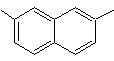
1-isopropil-6-metilnaftaleno | (MOb 15)
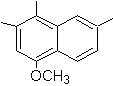
4-metox-1,2,7-trimetilnaftaleno |
Solução: (MOb 12).
Na estratégia que se assume, tem-se em conta que a última etapa pode responder a um processo de “aromatização”, para o qual se propõe que a molécula precursora apresente um anel não aromático, com dupla ligação.
no carbono que contém a ligação dupla e o grupo alquila.
Esta estrutura pode ser conseguida pela ação de um Grignard sobre uma carbonila e a posterior desidratação do álcool formado. A cetona é formada por acilação no composto de benzeno apropriado com anidrido succínico e seus subsequentes fechamentos de acilação intramolecular Friedel-Crafts.
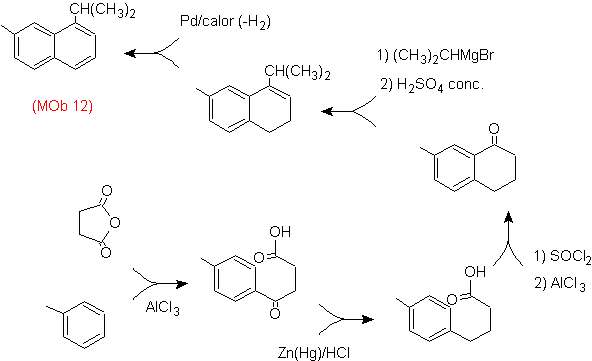
Solução (MOb 13).
Mais uma vez, a molécula precursora tem que ser "aromatizada", a estratégia mais adequada entre outras Baseia-se na combinação de acilação com anidrido succínico substituído e redução de Clemmensen.
A carbonila final é reduzida a álcool que será então desidratado com hidrogênio molecular e um catalisador chamado cromila de cobre.
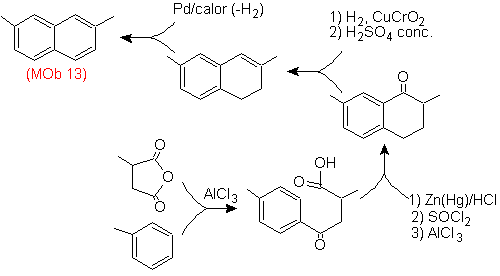
Solução (MOb 14).
A aromatização final é alcançada após a redução de um grupo carbonílico a álcool e sua desidratação. A molécula precursora é obtida com uma acilação com anidrido succínico.
A carbonila que tem que ser atacada por um Grignard para introduzir o grupo alquila e gerar o álcool que será desidratado, é temporariamente protegida como um acetal cíclico.
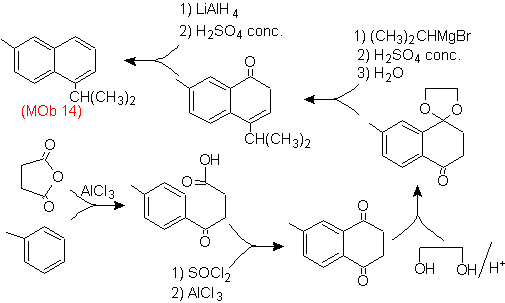
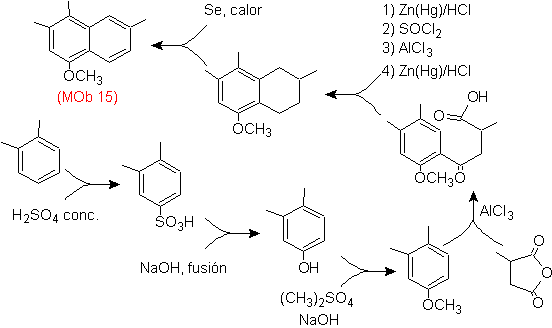
Solução Mob 15 .
Considera-se que o anel mais substituído corresponde ao anel aromático que por acilação adequado com um derivado de anidrido succínico, permitirá o fechamento de um anel, com uma combinação inteligente de acilação e redução da carbonila.
O anel benzênico com a funcionalidade necessária é preparado a partir do o-xileno, que é sulfonado e o grupo –OH é protegido por eterificação até o fim.
A acilação do naftaleno está sujeita a um interessante efeito solvente. A reação em dissulfeto de carbono ou solventes halogenados produz um ataque predominantemente na posição a , porém, em solução de nitrobenzeno, o tamanho do agente de ataque eletrofílico aumenta por solvatação com nitrobenzeno, atacando a posição b , que é menos impedida estericamente.
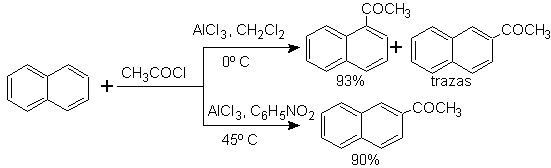
A succinoilação do naftaleno a nitrobenzeno produz uma mistura separável dos isômeros a e b , ambos usados na síntese de derivados do fenantreno.
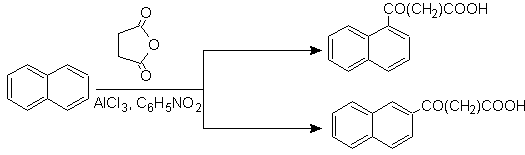
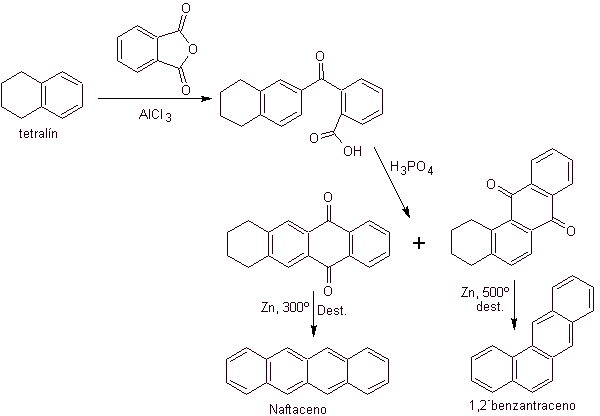
A tetralina é exclusivamente acilada na posição b , demonstrando a resistência dos derivados 2-ftaloil à ciclização na posição 3 para dar condensados lineares.
Exemplo: Sintetize o ácido p -bromobenzóico a partir do benzeno e os reagentes necessários. |
MOb 16 |
Solução (MOb 16).
É necessário perguntar "O que é um precursor imediato do ácido p-bromobenzóico?" A análise retrossintética de
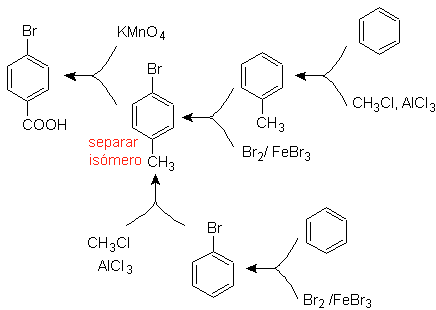
A melhor opção é aquela que utiliza o tolueno como intermediário, pois o grupo metil é fracamente ativador do anel benzênico e melhora o rendimento da formação do p-bromotolueno.
Na segunda rota de síntese, deve-se levar em consideração que o bromo é um desativante do anel e, portanto, o rendimento da reação será obviamente muito menor do que na primeira rota. Porém, deve-se entender que não há um único produto na síntese, pois também será formado o isômero orto-substituído, que deve necessariamente ser separado no processo de síntese.
Um segundo caso, que apresenta as características de uma multi-substituição eletrofílica do anel benzênico, é a síntese de 4-cloro-1-nitro-2-propilbenzeno (MOb. 17) a partir do benzeno.
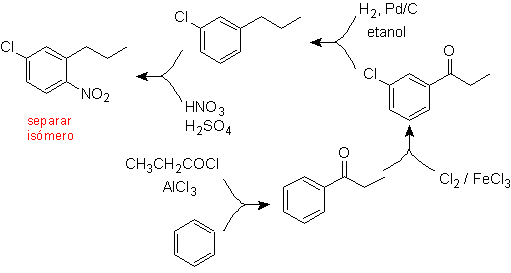
Solução (MOb 17).
Em princípio, existem três possíveis precursores dissubstituídos, mas apenas um deles é adequado. Também neste caso, existe uma alta probabilidade de formação do isômero 2-cloro-1-nitro-4-propilbenzeno.
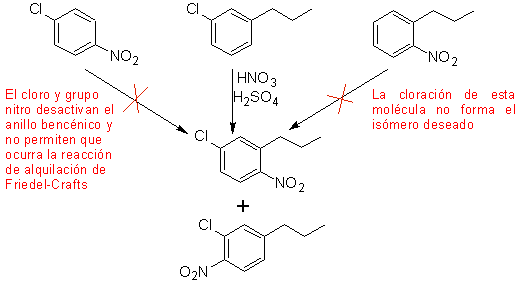
a síntese final de
Agora está claro que uma das tarefas do químico é projetar rotas de síntese que levem ao máximo à formação de um único produto com os maiores rendimentos, ou seja, evitando a formação de isômeros ao longo de todo o processo. Para exemplificar esse aspecto, estudaremos a síntese das seguintes moléculas:
MOb. 18
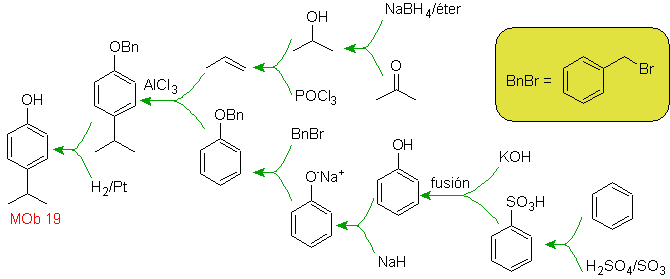
| MOb. 19
|
Solução MOb 18
O bromo é orientado orto e também desativando o anel benzênico, então a estratégia passa por colocar um grupo fortemente ativador nas posições orto e para de um novo eletrófilo e após gerar a reação, retirar o grupo ativador do anel benzeno.
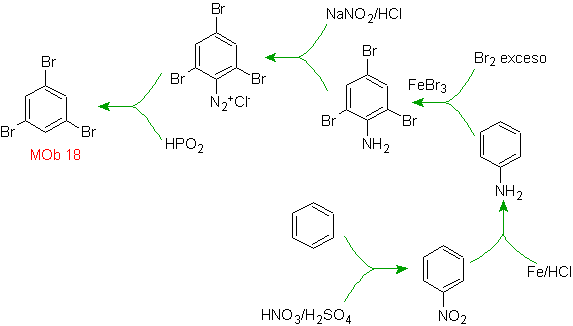
O grupo –OH é um forte ativador do anel benzênico e uma orientação orto-para. Consequentemente, podemos transformar o grupo –OH em um grupo muito maior, ou seja, volumoso, que exercerá um impedimento estérico para qualquer eletrófilo que se aproxime do anel e o oriente apenas para a posição para. Finalmente, o grupo –OH será restaurado, para atingir a molécula alvo.