REAÇÕES EM QUÍMICA ORGÂNICA
- Detalhes
- Germán Fernández
- REAÇÕES EM QUÍMICA ORGÂNICA
- Acessos: 12222
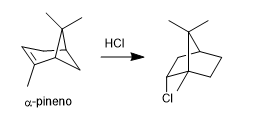
- Detalhes
- Germán Fernández
- REAÇÕES EM QUÍMICA ORGÂNICA
- Acessos: 13728
A oxidação Wacker permite a transformação de alcenos nas cetonas correspondentes por tratamento com Pd na presença de sais de cobre. O cobre tem a capacidade de oxidar paládio(0) a paládio(II), sendo este último o agente catalítico da reação.
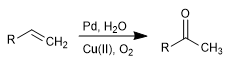
- Detalhes
- Germán Fernández
- REAÇÕES EM QUÍMICA ORGÂNICA
- Acessos: 13831
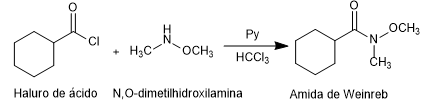
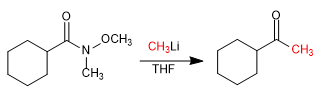
- Detalhes
- Germán Fernández
- REAÇÕES EM QUÍMICA ORGÂNICA
- Acessos: 8041
Em 1902, Wolff observou que tratar diazoacetofenona (α-diazocetona) com Ag 2 O/H 2 O produzia um rearranjo que gerava ácido fenilacético.
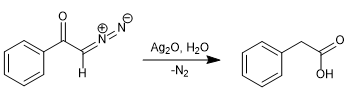
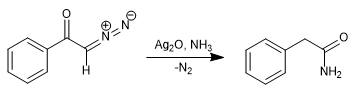
Substituindo a água por amônia, obtém-se a fenilacetamida.
- Detalhes
- Germán Fernández
- REAÇÕES EM QUÍMICA ORGÂNICA
- Acessos: 16203
- Detalhes
- Germán Fernández
- REAÇÕES EM QUÍMICA ORGÂNICA
- Acessos: 23659
- Detalhes
- Germán Fernández
- REAÇÕES EM QUÍMICA ORGÂNICA
- Acessos: 11061
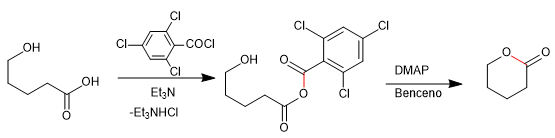
- Detalhes
- Germán Fernández
- REAÇÕES EM QUÍMICA ORGÂNICA
- Acessos: 8469
A fragmentação de Wharton é uma reação concertada na qual um grupo abandonador está localizado na posição 4 em relação a um grupo doador de elétrons. A transferência dos pares livres do grupo doador produz a fragmentação da ligação vizinha e a perda do grupo abandonador com a formação de ligações duplas. Vejamos um exemplo:
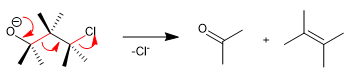
- Detalhes
- Germán Fernández
- REAÇÕES EM QUÍMICA ORGÂNICA
- Acessos: 7377
A síntese de Wharton permite que α,β-epoxicetonas sejam transformadas em álcoois alílicos por tratamento com hidrazina em meio ácido acético ou hidrato de hidrazina seguido de base forte. A \alfa,\beta-epoxicetona é obtida a partir da cetona \alfa,\beta-insaturada por oxidação com peróxido de hidrogênio em meio básico.
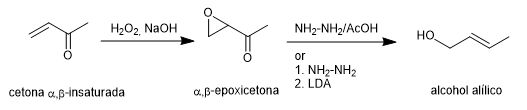
Ler mais: Síntese de Wharton de olefinas (rearranjo de Wharton)
- Detalhes
- Germán Fernández
- REAÇÕES EM QUÍMICA ORGÂNICA
- Acessos: 11607
A reação de Chugaev permite a formação de olefinas a partir de xantanas.
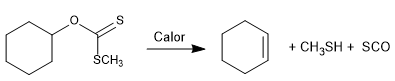
- Detalhes
- Germán Fernández
- REAÇÕES EM QUÍMICA ORGÂNICA
- Acessos: 22447
Aldeídos, sem hidrogênios alfa, dão a reação de Cannizzaro no tratamento com uma base forte (NaOH)
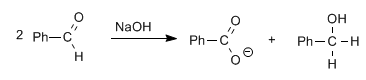
Nesta reação, uma molécula é reduzida a álcool, enquanto a outra é oxidada a ácido carboxílico.
- Detalhes
- Germán Fernández
- REAÇÕES EM QUÍMICA ORGÂNICA
- Acessos: 10252
A reação de Blanc permite a clorometilação de compostos aromáticos.
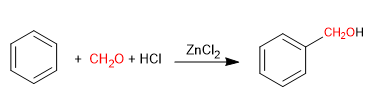
Utiliza como reagentes metano com cloreto de hidrogênio gasoso na presença de um ácido de Lewis. O resultado é a introdução de um grupo hidroximetil no anel aromático (benzeno) cuja hidroxila é substituída por cloro na presença de cloreto de hidrogênio.
- Detalhes
- Germán Fernández
- REAÇÕES EM QUÍMICA ORGÂNICA
- Acessos: 12999
A reação de Beckmann produz o rearranjo de uma oxima em uma amida. Esta reação é realizada em meio ácido.
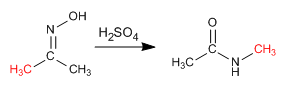
- Detalhes
- Germán Fernández
- REAÇÕES EM QUÍMICA ORGÂNICA
- Acessos: 14215
- Detalhes
- Germán Fernández
- REAÇÕES EM QUÍMICA ORGÂNICA
- Acessos: 9751
A reação de Barbier possibilita a obtenção de reagentes organometálicos instáveis no meio reacional. Inicialmente foi realizado com magnésio metálico, gerando magnésio in situ. Posteriormente estendeu-se a outros metais: Sn, Zn..., podendo trabalhar em meio aquoso, sem necessitar da proteção de grupos ácidos (hidroxilas).
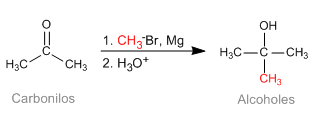
- Detalhes
- Germán Fernández
- REAÇÕES EM QUÍMICA ORGÂNICA
- Acessos: 10740
A reação de Schiemann consiste na decomposição térmica de tetrafluoroboratos de diazônio aromáticos para produzir o derivado fluorado correspondente. Embora os sais de diazônio não sejam testáveis, os tetrafluoroboratos de diazônio têm estabilidade significativa e podem ser preparados com bom rendimento. O tetrafluoroborato de diazônio é preparado a partir de aminas aromáticas pela reação de diazotização.
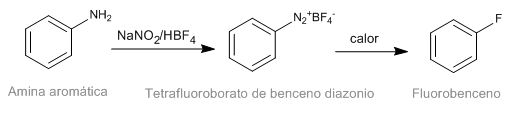
- Detalhes
- Germán Fernández
- REAÇÕES EM QUÍMICA ORGÂNICA
- Acessos: 8901
O rearranjo de Baker-Venkataraman transforma orto-aciloxicetonas aromáticas em beta-dicetonas por tratamento básico (catálise). As beta-dicetonas são de grande interesse na síntese de cromonas, flavonas e cumarinas. As bases mais utilizadas na reação são: KOH, terc-butóxido de potássio, sódio em tolueno, hidreto de potássio.
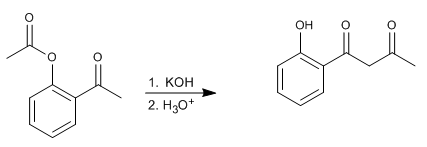
- Detalhes
- Germán Fernández
- REAÇÕES EM QUÍMICA ORGÂNICA
- Acessos: 10404
Os 1,5-dienos isomerizam-se por rearranjos sigmatrópicos-[3,3] sob aquecimento. Reação conhecida como rearranjo de Cope. O rearranjo de 1,5-dienos N-substituídos é chamado de rearranjo aza-Cope. Dependendo da posição ocupada pelo nitrogênio temos: 1-aza-, 2-aza-, 3-aza-Cope. O reagrupamento 3-aza-Cope coincide com o aza-Claisen.
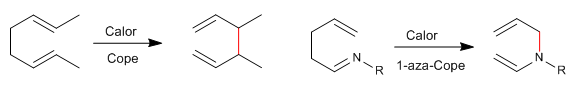
- Detalhes
- Germán Fernández
- REAÇÕES EM QUÍMICA ORGÂNICA
- Acessos: 10099
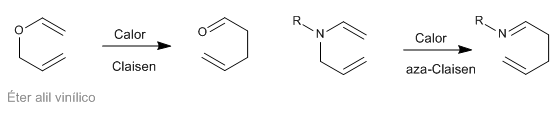
Os rearranjos Sigmatrópicos [3,3] de N-alilenoaminas são conhecidos como rearranjos aza-Claisen. Esta reação é análoga ao rearranjo de Claisen dos éteres alílicos vinílicos.
- Detalhes
- Germán Fernández
- REAÇÕES EM QUÍMICA ORGÂNICA
- Acessos: 8719
Reação análoga ao rearranjo de Wittig, em que os éteres de metais alfa rearranjam os alcóxidos, gerando álcoois secundários ou terciários após a hidrólise. No caso de aza-[2,3]-Wittig, trata-se de aminas terciárias alílicas alfa-metaladas que produzem aminas secundárias após a hidrólise.










