TEORIA DO PIRROL, TIOFENO E FURANO
- Detalhes
- Germán Fernández
- TEORIA DO PIRROL, TIOFENO E FURANO
- Acessos: 14075
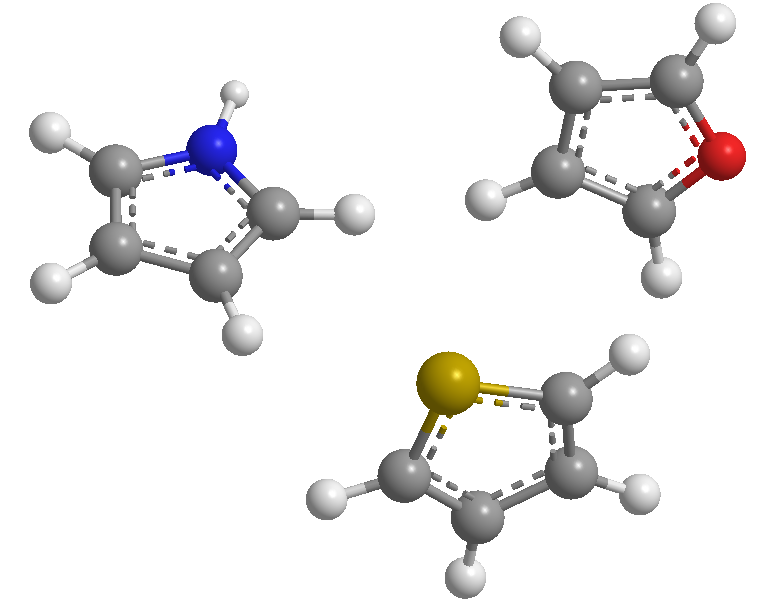
Estes são heterociclos de 5 membros cujos heteroátomos são nitrogênio, enxofre e oxigênio. São sistemas aromáticos (obedecem à regra de Hückel), sendo o tiofeno o de maior energia de estabilização (mais aromático), seguido do pirrol, sendo o furano o menos aromático devido à forte eletronegatividade do oxigênio que dificulta a deslocalização do oxigênio . a nuvem eletrônica.
[1] Pirrole
[2] Tiofeno
[3] Furano
- Detalhes
- Germán Fernández
- TEORIA DO PIRROL, TIOFENO E FURANO
- Acessos: 20530
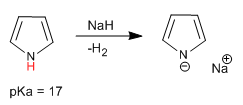
O pirrol tem um hidrogênio ácido no átomo de nitrogênio com pKa = 17. No caso do tiofeno e do furano, os hidrogênios ácidos estão localizados na posição 2, embora tenham uma acidez muito menor que o pirrol.
- Detalhes
- Germán Fernández
- TEORIA DO PIRROL, TIOFENO E FURANO
- Acessos: 13336
Dos três heterociclos estudados neste tópico, o pirrol é o mais reativo na substituição eletrofílica. Em meio ácido polimeriza, nitra na presença de ácido nítrico e anidrido acético, sulfona com o complexo piridina-SO 3 , halogênio na presença de soluções diluídas de halogênio a baixa temperatura e dá as reações de Vilsmeier e Mannich.
- Detalhes
- Germán Fernández
- TEORIA DO PIRROL, TIOFENO E FURANO
- Acessos: 13125
O pirrol é nitrado com nítrico em anidrido acético, uma vez que a mistura sulfonítrica produz polimerização.
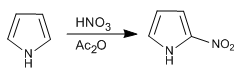
- Detalhes
- Germán Fernández
- TEORIA DO PIRROL, TIOFENO E FURANO
- Acessos: 12940
a) Halogenação do pirrol
Para evitar a polihalogenação, deve-se trabalhar com halogênio diluído e em baixa temperatura. Outra opção é usar NBS ou NCS.
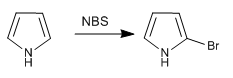
- Detalhes
- Germán Fernández
- TEORIA DO PIRROL, TIOFENO E FURANO
- Acessos: 18963
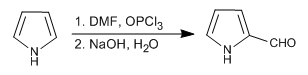
- Detalhes
- Germán Fernández
- TEORIA DO PIRROL, TIOFENO E FURANO
- Acessos: 12702
A reação de Mannich permite colocar o grupo aminometil na posição 2 do pirrol.
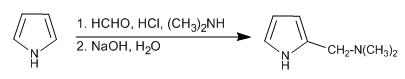
- Detalhes
- Germán Fernández
- TEORIA DO PIRROL, TIOFENO E FURANO
- Acessos: 10328
É possível adicionar eletrófilos à posição 3,4 do pirrol colocando grupos volumosos no átomo de nitrogênio, de modo que as posições 2,5 sejam evitadas. Um dos grupos mais utilizados é o triisopropilsilil.
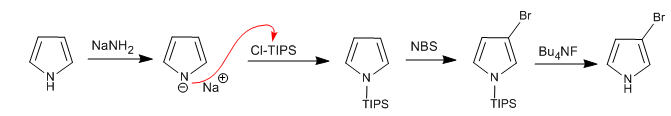
Ler mais: Substituição eletrofílica na posição 3 do pirrol usando Cl-TIPS
- Detalhes
- Germán Fernández
- TEORIA DO PIRROL, TIOFENO E FURANO
- Acessos: 11850
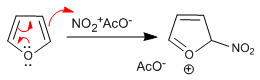
Furan nitra com ácido nítrico em anidrido acético, porém, devido a sua baixa aromaticidade é atacado por nucleófilos no meio na sua posição 5 e requer uma etapa final de tratamento básico ou aquecimento para restaurar a aromaticidade.
Etapa 1. Geração do eletrófito
![]()
Estágio 2. Ataque nucleofílico de furano em acetato de nitrônio
- Detalhes
- Germán Fernández
- TEORIA DO PIRROL, TIOFENO E FURANO
- Acessos: 11486
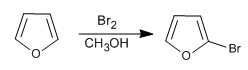
Embora seja menos reativo que o pirrol em S E , ainda apresenta problemas com polihalogenações, por isso é necessário usar halogênios diluídos e em baixas temperaturas. NBS e NCS também podem ser usados.
- Detalhes
- Germán Fernández
- TEORIA DO PIRROL, TIOFENO E FURANO
- Acessos: 1769
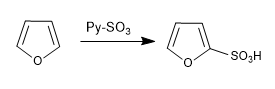
a) Sulfonação do furano:
As furano sulfonas com o complexo SO 3 -Py
d) Formulação de Vilsmeier
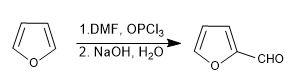
Ler mais: Sulfonação, formilação, Mannich e acetilação de furano
- Detalhes
- Germán Fernández
- TEORIA DO PIRROL, TIOFENO E FURANO
- Acessos: 2114
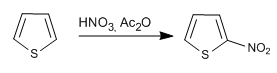
Os reagentes e as condições de reação são semelhantes aos usados no pirrol.
a) Nitração do tiofeno
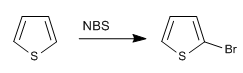
b) Halogenação do tiofeno
- Detalhes
- Germán Fernández
- TEORIA DO PIRROL, TIOFENO E FURANO
- Acessos: 2240
Pirrole, tiofeno e furano não são atacados por nucleófilos devido à forte densidade eletrônica do anel (excent p systems). Portanto, reações de adição nucleofílica, características de sistemas deficientes em p, como piridina, quinolina e isoquinolina, não são observadas.
- Detalhes
- Germán Fernández
- TEORIA DO PIRROL, TIOFENO E FURANO
- Acessos: 2192
A incapacidade de estabilizar o intermediário formado após o ataque nucleofílico torna essa reação impossível em heterociclos de 5 membros. No entanto, a presença de grupos desativadores ligados ao anel pode suprir essa deficiência, permitindo a reação.
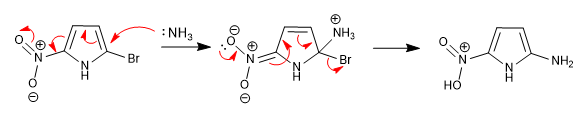
O nitro localizado na posição 5 permite a deslocalização da carga gerada durante a etapa de adição.
- Detalhes
- Germán Fernández
- TEORIA DO PIRROL, TIOFENO E FURANO
- Acessos: 2323
A reação de heterociclos halogenados com organometálicos de lítio produz a troca de halogênio pelo metal, gerando um novo organometálico que permite atacar uma grande variedade de eletrófilos.
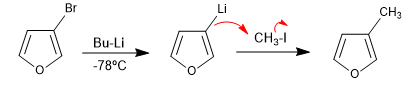
- Detalhes
- Germán Fernández
- TEORIA DO PIRROL, TIOFENO E FURANO
- Acessos: 2490
A baixa aromaticidade do furano permite que ele participe de reações que destroem a conjugação do anel, tais como: Diels-Alder, 1,3-dipolar, fotoquímica e quelotrópica.
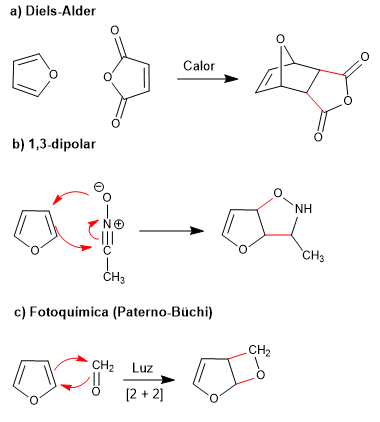
- Detalhes
- Germán Fernández
- TEORIA DO PIRROL, TIOFENO E FURANO
- Acessos: 2384
a) Saindo do grupo próximo ao ringue
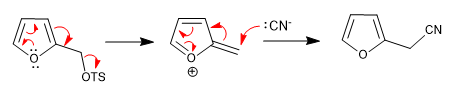
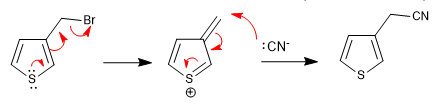
- Detalhes
- Germán Fernández
- TEORIA DO PIRROL, TIOFENO E FURANO
- Acessos: 2703
Furan abre em meio ácido aquoso para formar 1,4-dicarbonilos. A reação segue as etapas inversas da síntese de Paal-Knorr.
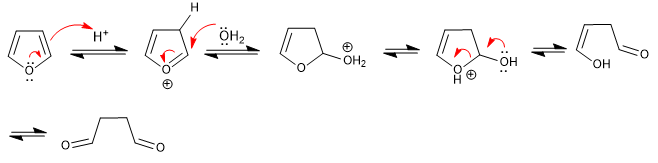
- Detalhes
- Germán Fernández
- TEORIA DO PIRROL, TIOFENO E FURANO
- Acessos: 3192
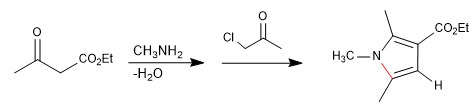
Gera pirróis por reação de 1,4-dicarbonilas com aminas ou amônia.
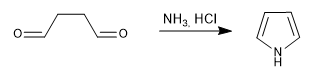
- Detalhes
- Germán Fernández
- TEORIA DO PIRROL, TIOFENO E FURANO
- Acessos: 2788
Consiste na reação de uma amina primária com um 3-cetoéster formando uma imina, que posteriormente tautomeriza a enamnina, atacando uma a-halocetona. Em uma etapa de ciclização subsequente, o pirrol é obtido.