PYRROL-, THIOPHEN- UND FURAN-THEORIE
- Details
- Germán Fernández
- PYRROL-, THIOPHEN- UND FURAN-THEORIE
- Zugriffe: 14703
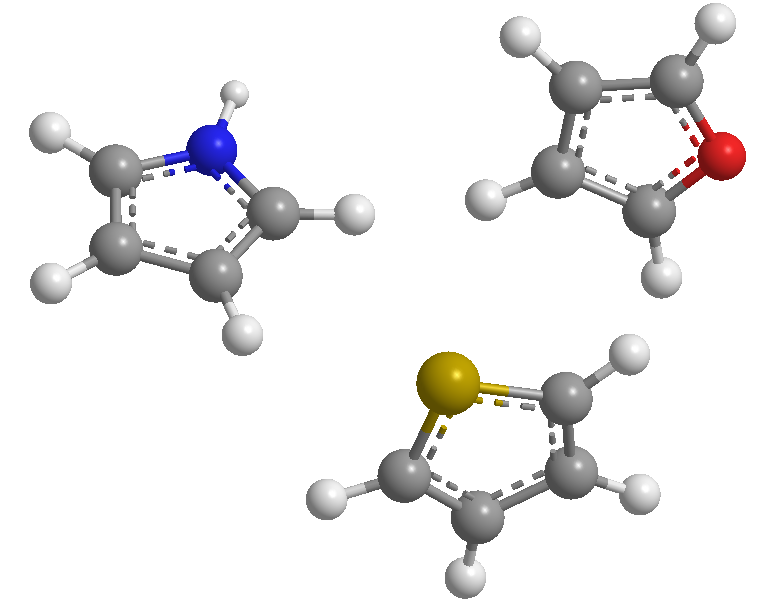
Dies sind 5-gliedrige Heterocyclen, deren Heteroatome Stickstoff, Schwefel und Sauerstoff sind. Sie sind aromatische Systeme (sie entsprechen der Hückel-Regel), wobei Thiophen dasjenige mit der höchsten Stabilisierungsenergie (aromatischer) ist, gefolgt von Pyrrol, wobei Furan aufgrund der starken Elektronegativität von Sauerstoff, die die Delokalisierung von Sauerstoff erschwert, das am wenigsten aromatische ist Die elektronische Wolke.
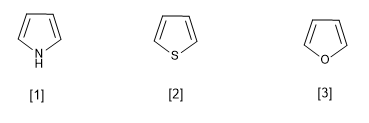
[1] Pyrrol
[2] Thiophen
[3] Furan
- Details
- Germán Fernández
- PYRROL-, THIOPHEN- UND FURAN-THEORIE
- Zugriffe: 21110
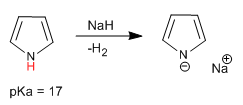
Pyrrol hat am Stickstoffatom einen Säurewasserstoff mit pKa = 17. Bei Thiophen und Furan befinden sich die Säurewasserstoffe in Position 2, obwohl sie eine viel geringere Acidität als Pyrrol haben.
- Details
- Germán Fernández
- PYRROL-, THIOPHEN- UND FURAN-THEORIE
- Zugriffe: 13235
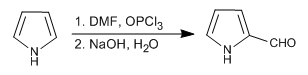
Von den drei in diesem Thema untersuchten Heterocyclen ist Pyrrol der reaktivste bei der elektrophilen Substitution. In sauren Medien polymerisiert es, Nitra in Gegenwart von Salpetersäure und Essigsäureanhydrid, Sulfon mit dem Pyridin-SO 3 -Komplex, Halogen in Gegenwart verdünnter Halogenlösungen bei niedriger Temperatur und ergibt die Vilsmeier- und Mannich-Reaktionen.
- Details
- Germán Fernández
- PYRROL-, THIOPHEN- UND FURAN-THEORIE
- Zugriffe: 13728
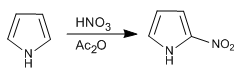
Pyrrol wird mit Salpetersäure in Essigsäureanhydrid nitriert, da die Sulfonsäuremischung eine Polymerisation bewirkt.
- Details
- Germán Fernández
- PYRROL-, THIOPHEN- UND FURAN-THEORIE
- Zugriffe: 13310
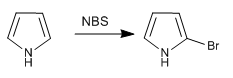
a) Halogenierung von Pyrrol
Um eine Polyhalogenierung zu vermeiden, sollte mit verdünntem Halogen und bei niedriger Temperatur gearbeitet werden. Eine weitere Option ist die Verwendung von NBS oder NCS.
- Details
- Germán Fernández
- PYRROL-, THIOPHEN- UND FURAN-THEORIE
- Zugriffe: 19370
- Details
- Germán Fernández
- PYRROL-, THIOPHEN- UND FURAN-THEORIE
- Zugriffe: 13126
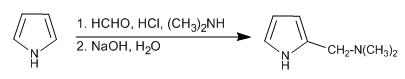
Die Mannich-Reaktion ermöglicht die Platzierung der Aminomethylgruppe an Position 2 des Pyrrols.
- Details
- Germán Fernández
- PYRROL-, THIOPHEN- UND FURAN-THEORIE
- Zugriffe: 10824
Es ist möglich, Elektrophile an die 3,4-Position des Pyrrols zu addieren, indem sperrige Gruppen an das Stickstoffatom platziert werden, so dass die 2,5-Positionen verhindert werden. Eine der am häufigsten verwendeten Gruppen ist Triisopropylsilyl.
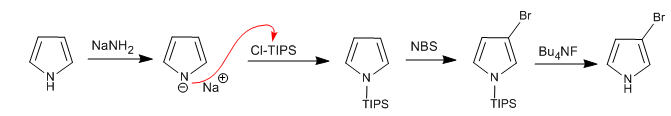
Weiterlesen: Elektrophile Substitution an Position 3 von Pyrrol mit Cl-TIPS
- Details
- Germán Fernández
- PYRROL-, THIOPHEN- UND FURAN-THEORIE
- Zugriffe: 12371
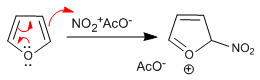
Furannitra mit Salpetersäure in Essigsäureanhydrid wird jedoch aufgrund seiner geringen Aromatizität von Nukleophilen im Medium an seiner 5-Position angegriffen und erfordert eine letzte Stufe einer basischen Behandlung oder Erhitzung, um die Aromatizität wiederherzustellen.
Stufe 1. Erzeugung des Elektrophyten
![]()
Stufe 2. Nucleophiler Angriff von Furan auf Nitroniumacetat
- Details
- Germán Fernández
- PYRROL-, THIOPHEN- UND FURAN-THEORIE
- Zugriffe: 11940
Obwohl es in S E weniger reaktiv als Pyrrol ist, hat es immer noch Probleme mit Polyhalogenierungen, so dass es erforderlich ist, verdünnte Halogene und bei niedrigen Temperaturen zu verwenden. NBS und NCS können ebenfalls verwendet werden.
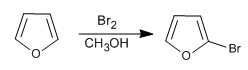
- Details
- Germán Fernández
- PYRROL-, THIOPHEN- UND FURAN-THEORIE
- Zugriffe: 2290
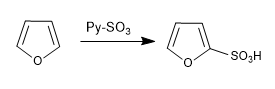
a) Sulfonierung von Furan:
Die Furansulfone mit dem SO 3 -Py-Komplex
d) Vilsmeier-Formulierung
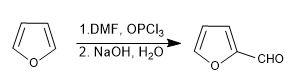
Weiterlesen: Sulfonierung, Formylierung, Mannich und Acetylierung von Furan
- Details
- Germán Fernández
- PYRROL-, THIOPHEN- UND FURAN-THEORIE
- Zugriffe: 2682
Die Reagenzien und Reaktionsbedingungen sind ähnlich denen, die in Pyrrol verwendet werden.
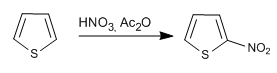
a) Nitrierung von Thiophen
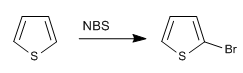
b) Halogenierung von Thiophen
- Details
- Germán Fernández
- PYRROL-, THIOPHEN- UND FURAN-THEORIE
- Zugriffe: 1755
Pyrrol, Thiophen und Furan werden aufgrund der starken Elektronendichte des Rings (excent p -Systeme) nicht von Nucleophilen angegriffen. Daher werden keine nukleophilen Additionsreaktionen beobachtet, die für p- defiziente Systeme wie Pyridin, Chinolin und Isochinolin charakteristisch sind.
- Details
- Germán Fernández
- PYRROL-, THIOPHEN- UND FURAN-THEORIE
- Zugriffe: 2122
Die Unfähigkeit, das nach dem nukleophilen Angriff gebildete Zwischenprodukt zu stabilisieren, macht diese Reaktion in 5-gliedrigen Heterocyclen unmöglich. Das Vorhandensein von an den Ring gebundenen desaktivierenden Gruppen kann diesen Mangel jedoch ausgleichen und die Reaktion ermöglichen.
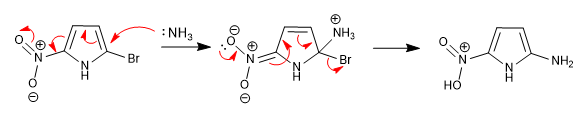
Das in Position 5 befindliche Nitro ermöglicht die Delokalisierung der während der Additionsstufe erzeugten Ladung.
- Details
- Germán Fernández
- PYRROL-, THIOPHEN- UND FURAN-THEORIE
- Zugriffe: 2225
Die Reaktion von halogenierten Heterocyclen mit metallorganischen Lithiumverbindungen führt zum Austausch von Halogen gegen das Metall, wodurch eine neue metallorganische Verbindung entsteht, die den Angriff auf eine Vielzahl von Elektrophilen ermöglicht.
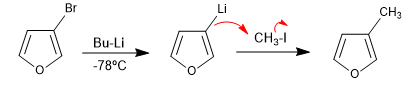
- Details
- Germán Fernández
- PYRROL-, THIOPHEN- UND FURAN-THEORIE
- Zugriffe: 2205
Die geringe Aromatizität von Furan ermöglicht die Teilnahme an Reaktionen, die die Konjugation des Rings zerstören, wie z. B.: Diels-Alder, 1,3-dipolar, photochemisch und kelotrop.
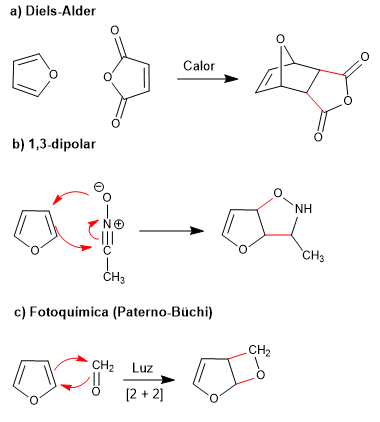
- Details
- Germán Fernández
- PYRROL-, THIOPHEN- UND FURAN-THEORIE
- Zugriffe: 1999
a) Abgangsgruppe in der Nähe des Rings
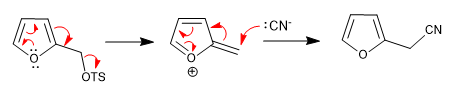
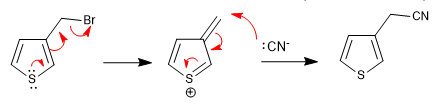
- Details
- Germán Fernández
- PYRROL-, THIOPHEN- UND FURAN-THEORIE
- Zugriffe: 1841
Furan öffnet sich in wässrigen Säuremedien, um 1,4-Dicarbonyle zu bilden. Die Reaktion folgt den umgekehrten Schritten der Paal-Knorr-Synthese.
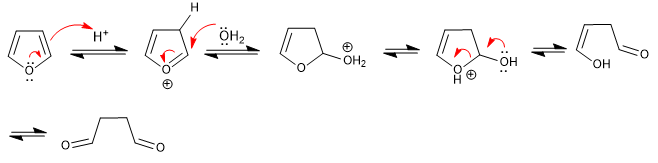
- Details
- Germán Fernández
- PYRROL-, THIOPHEN- UND FURAN-THEORIE
- Zugriffe: 3005
Erzeugt Pyrrole durch Reaktion von 1,4-Dicarbonylen mit Aminen oder Ammoniak.
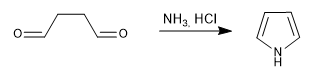
- Details
- Germán Fernández
- PYRROL-, THIOPHEN- UND FURAN-THEORIE
- Zugriffe: 2177
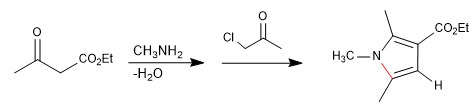
Es besteht aus der Reaktion eines primären Amins mit einem 3-Ketoester unter Bildung eines Imins, das später zu Enamnin tautomerisiert und ein a-Haloketon angreift. In einer anschließenden Cyclisierungsstufe wird Pyrrol erhalten.