THÉORIE DU PYRROL, DU THIOPHÈNE ET DU FURAN
- Détails
- Germán Fernández
- THÉORIE DU PYRROL, DU THIOPHÈNE ET DU FURAN
- Affichages : 14713
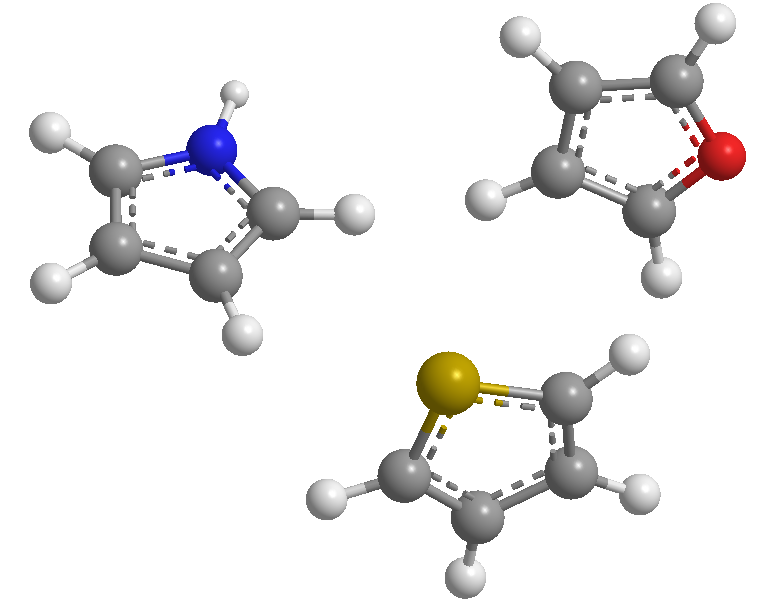
Ce sont des hétérocycles à 5 chaînons dont les hétéroatomes sont l'azote, le soufre et l'oxygène. Ce sont des systèmes aromatiques (ils respectent la règle de Hückel), le thiophène étant celui qui possède l'énergie de stabilisation la plus élevée (plus aromatique), suivi du pyrrole, le furane étant le moins aromatique en raison de la forte électronégativité de l'oxygène qui rend difficile la délocalisation de l'oxygène .le nuage électronique.
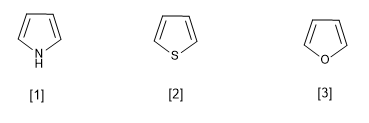
[1] Pyrrole
[2] Thiophène
[3] Furane
- Détails
- Germán Fernández
- THÉORIE DU PYRROL, DU THIOPHÈNE ET DU FURAN
- Affichages : 21569
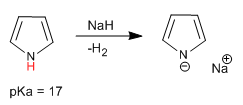
Le pyrrole a un hydrogène acide sur l'atome d'azote avec un pKa = 17. Dans le cas du thiophène et du furane, les hydrogènes acides sont situés en position 2, bien qu'ils aient une acidité beaucoup plus faible que le pyrrole.
Lire la suite : Comportement de base du pyrrole, du thiophène et du furane
- Détails
- Germán Fernández
- THÉORIE DU PYRROL, DU THIOPHÈNE ET DU FURAN
- Affichages : 13935
Des trois hétérocycles étudiés dans ce sujet, le pyrrole est le plus réactif en substitution électrophile. En milieu acide il polymérise, nitra en présence d'acide nitrique et d'anhydride acétique, sulfone avec le complexe pyridine-SO 3 , halogène en présence de solutions diluées d'halogène à basse température et donne les réactions de Vilsmeier et Mannich.
- Détails
- Germán Fernández
- THÉORIE DU PYRROL, DU THIOPHÈNE ET DU FURAN
- Affichages : 14051
Le pyrrole est nitré avec du nitrique dans l'anhydride acétique puisque le mélange sulfonitrique produit une polymérisation.
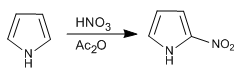
- Détails
- Germán Fernández
- THÉORIE DU PYRROL, DU THIOPHÈNE ET DU FURAN
- Affichages : 13533
a) Halogénation du pyrrole
Pour éviter la polyhalogénation, il convient de travailler avec un halogène dilué et à basse température. Une autre option consiste à utiliser NBS ou NCS.
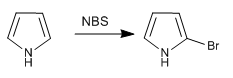
- Détails
- Germán Fernández
- THÉORIE DU PYRROL, DU THIOPHÈNE ET DU FURAN
- Affichages : 19815
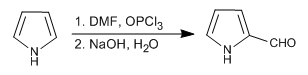
- Détails
- Germán Fernández
- THÉORIE DU PYRROL, DU THIOPHÈNE ET DU FURAN
- Affichages : 13442
La réaction de Mannich permet de placer le groupement aminométhyle en position 2 du pyrrole.
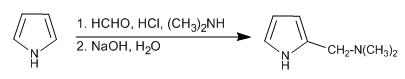
- Détails
- Germán Fernández
- THÉORIE DU PYRROL, DU THIOPHÈNE ET DU FURAN
- Affichages : 10864
Il est possible d'ajouter des électrophiles à la position 3,4 du pyrrole en plaçant des groupes volumineux sur l'atome d'azote, de sorte que les positions 2,5 sont empêchées. L'un des groupes les plus utilisés est le triisopropylsilyle.
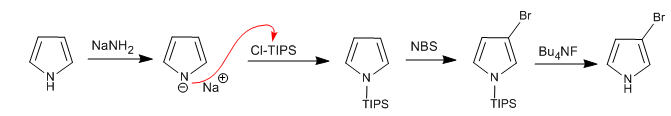
Lire la suite : Substitution électrophile en position 3 du pyrrole à l'aide de Cl-TIPS
- Détails
- Germán Fernández
- THÉORIE DU PYRROL, DU THIOPHÈNE ET DU FURAN
- Affichages : 12480
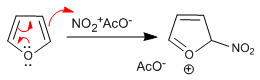
Le furane nitra avec l'acide nitrique dans l'anhydride acétique, du fait de sa faible aromaticité est cependant attaqué par les nucléophiles du milieu en sa position 5 et nécessite une dernière étape de traitement basique ou de chauffage pour rétablir l'aromaticité.
Étape 1. Génération de l'électrophyte
![]()
Étape 2. Attaque nucléophile du furane sur l'acétate de nitronium
- Détails
- Germán Fernández
- THÉORIE DU PYRROL, DU THIOPHÈNE ET DU FURAN
- Affichages : 11739
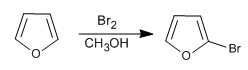
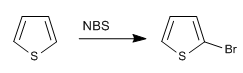
Bien qu'il soit moins réactif que le pyrrole dans S E , il présente toujours des problèmes de polyhalogénations, il est donc nécessaire d'utiliser des halogènes dilués et à basse température. NBS et NCS peuvent également être utilisés.
- Détails
- Germán Fernández
- THÉORIE DU PYRROL, DU THIOPHÈNE ET DU FURAN
- Affichages : 3252
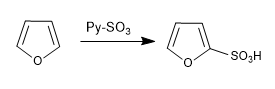
a) Sulfonation du furanne :
Les furanes sulfones avec le complexe SO 3 -Py
d) Formulation de Vilsmeier
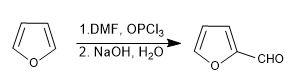
Lire la suite : Sulfonation, formylation, Mannich et acétylation du furane
- Détails
- Germán Fernández
- THÉORIE DU PYRROL, DU THIOPHÈNE ET DU FURAN
- Affichages : 2090
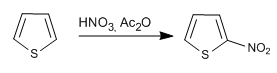
Les réactifs et les conditions de réaction sont similaires à ceux utilisés dans le pyrrole.
a) Nitratation du thiophène
b) Halogénation du thiophène
- Détails
- Germán Fernández
- THÉORIE DU PYRROL, DU THIOPHÈNE ET DU FURAN
- Affichages : 2015
Le pyrrole, le thiophène et le furane ne sont pas attaqués par les nucléophiles en raison de la forte densité électronique du cycle (systèmes excent p ). Par conséquent, les réactions d'addition nucléophiles, caractéristiques des systèmes déficients en p tels que la pyridine, la quinoléine et l'isoquinoléine, ne sont pas observées.
- Détails
- Germán Fernández
- THÉORIE DU PYRROL, DU THIOPHÈNE ET DU FURAN
- Affichages : 1951
L'incapacité à stabiliser l'intermédiaire formé après attaque nucléophile rend cette réaction impossible dans les hétérocycles à 5 chaînons. Cependant, la présence de groupements désactivants attachés au cycle peut pallier ce manque, permettant la réaction.
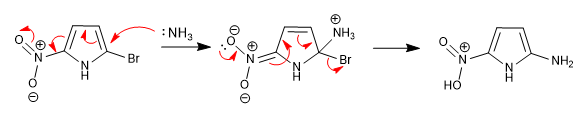
Le nitro situé en position 5 permet la délocalisation de la charge générée lors de l'étape d'addition.
- Détails
- Germán Fernández
- THÉORIE DU PYRROL, DU THIOPHÈNE ET DU FURAN
- Affichages : 2339
La réaction des hétérocycles halogénés avec les organométalliques du lithium produit l'échange d'halogène contre le métal, générant un nouvel organométallique qui permet d'attaquer une grande variété d'électrophiles.
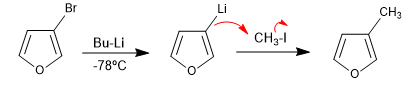
- Détails
- Germán Fernández
- THÉORIE DU PYRROL, DU THIOPHÈNE ET DU FURAN
- Affichages : 1975
La faible aromaticité du furane lui permet de participer à des réactions qui détruisent la conjugaison du cycle, telles que : Diels-Alder, 1,3-dipolaire, photochimique et kélotrope.
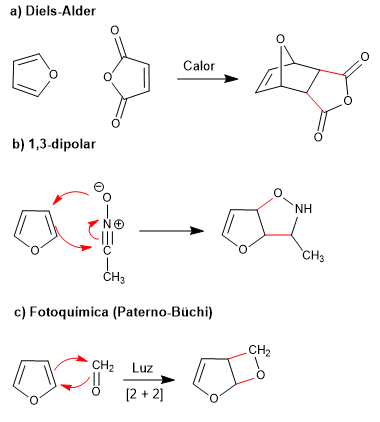
- Détails
- Germán Fernández
- THÉORIE DU PYRROL, DU THIOPHÈNE ET DU FURAN
- Affichages : 2424
a) Départ du groupe près du ring
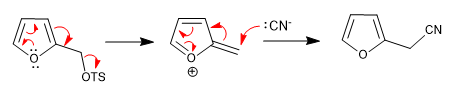
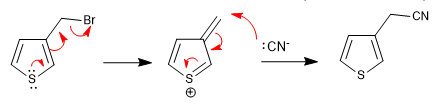
- Détails
- Germán Fernández
- THÉORIE DU PYRROL, DU THIOPHÈNE ET DU FURAN
- Affichages : 2071
Le furane s'ouvre dans un milieu acide aqueux pour former des 1,4-dicarbonyles. La réaction suit les étapes inverses de la synthèse de Paal-Knorr.
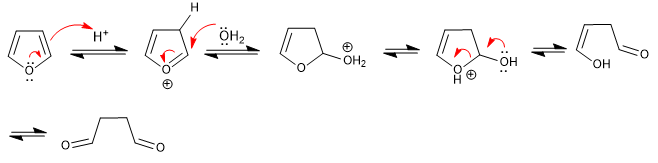
- Détails
- Germán Fernández
- THÉORIE DU PYRROL, DU THIOPHÈNE ET DU FURAN
- Affichages : 3858
Génère des pyrroles par réaction de 1,4-dicarbonyles avec des amines ou de l'ammoniac.
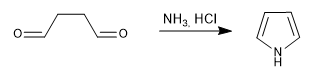
- Détails
- Germán Fernández
- THÉORIE DU PYRROL, DU THIOPHÈNE ET DU FURAN
- Affichages : 3543
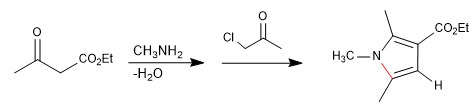
Il consiste en la réaction d'une amine primaire avec un 3-cétoester formant une imine, qui se tautomérise plus tard en énamnine, attaquant une a-halocétone. Dans une étape ultérieure de cyclisation, le pyrrole est obtenu.