ТЕОРИЯ ПИРРОЛА, ТИОФЕНА И ФУРАНА
- Информация о материале
- Germán Fernández
- ТЕОРИЯ ПИРРОЛА, ТИОФЕНА И ФУРАНА
- Просмотров: 14598
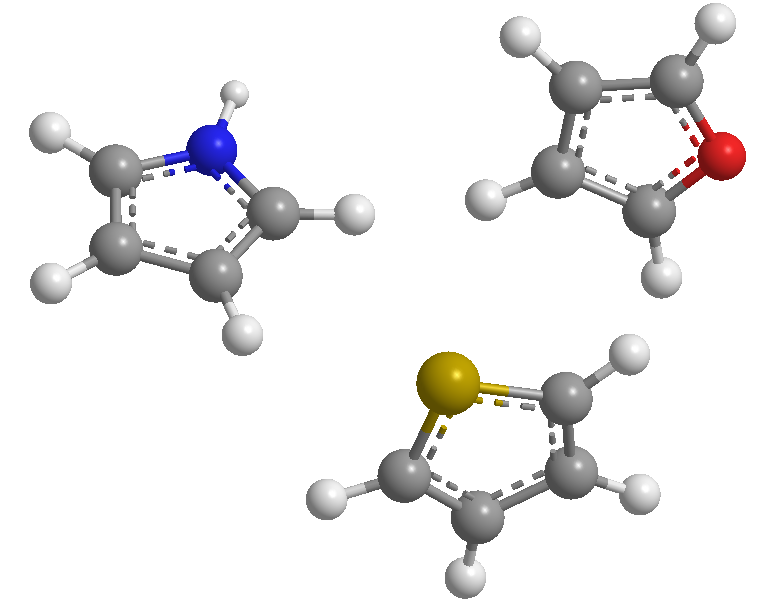
Это 5-членные гетероциклы, гетероатомами которых являются азот, сера и кислород. Это ароматические системы (они соответствуют правилу Хюккеля), причем тиофен обладает наибольшей энергией стабилизации (более ароматический), за ним следует пиррол, а фуран является наименее ароматическим из-за сильной электроотрицательности кислорода, что затрудняет делокализацию кислорода. , электронное облако.
[1] Пиррол
[2] Тиофен
[3] Фуран
- Информация о материале
- Germán Fernández
- ТЕОРИЯ ПИРРОЛА, ТИОФЕНА И ФУРАНА
- Просмотров: 20675
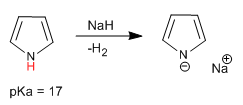
Пиррол имеет кислый водород при атоме азота с pKa = 17. В случае тиофена и фурана кислые водороды находятся в положении 2, хотя они имеют гораздо более низкую кислотность, чем пиррол.
- Информация о материале
- Germán Fernández
- ТЕОРИЯ ПИРРОЛА, ТИОФЕНА И ФУРАНА
- Просмотров: 13495
Из трех изученных в этой теме гетероциклов пиррол является наиболее реакционноспособным в электрофильном замещении. В кислых средах полимеризуется, нитра — в присутствии азотной кислоты и уксусного ангидрида, сульфона — с комплексом пиридин-SO 3 , галогена — в присутствии разбавленных растворов галогена при низкой температуре и дает реакции Вильсмейера и Манниха.
- Информация о материале
- Germán Fernández
- ТЕОРИЯ ПИРРОЛА, ТИОФЕНА И ФУРАНА
- Просмотров: 14723
Пиррол нитруется азотной кислотой в уксусном ангидриде, так как сульфонитовая смесь вызывает полимеризацию.
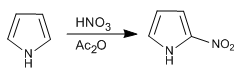
- Информация о материале
- Germán Fernández
- ТЕОРИЯ ПИРРОЛА, ТИОФЕНА И ФУРАНА
- Просмотров: 14455
а) Галогенирование пиррола
Во избежание полигалогенирования следует работать с разбавленным галогеном и при низкой температуре. Другой вариант — использовать NBS или NCS.
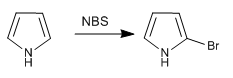
- Информация о материале
- Germán Fernández
- ТЕОРИЯ ПИРРОЛА, ТИОФЕНА И ФУРАНА
- Просмотров: 19050
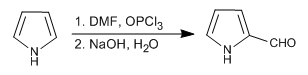
- Информация о материале
- Germán Fernández
- ТЕОРИЯ ПИРРОЛА, ТИОФЕНА И ФУРАНА
- Просмотров: 12883
Реакция Манниха позволяет поместить аминометильную группу в положение 2 пиррола.
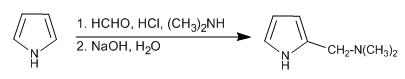
- Информация о материале
- Germán Fernández
- ТЕОРИЯ ПИРРОЛА, ТИОФЕНА И ФУРАНА
- Просмотров: 10336
Можно добавить электрофилы в положение 3,4 пиррола, поместив объемные группы на атом азота, чтобы предотвратить положение 2,5. Одной из наиболее часто используемых групп является триизопропилсилил.
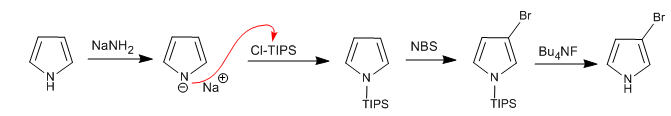
Подробнее: Электрофильное замещение в положении 3 пиррола с использованием Cl-TIPS
- Информация о материале
- Germán Fernández
- ТЕОРИЯ ПИРРОЛА, ТИОФЕНА И ФУРАНА
- Просмотров: 13814
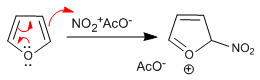
Однако нитра фурана с азотной кислотой в уксусном ангидриде из-за его низкой ароматичности подвергается атаке нуклеофилов в среде в его 5-м положении и требует заключительной стадии основной обработки или нагревания для восстановления ароматичности.
Этап 1. Генерация электрофита
![]()
Стадия 2. Нуклеофильная атака фурана на ацетат нитрония
- Информация о материале
- Germán Fernández
- ТЕОРИЯ ПИРРОЛА, ТИОФЕНА И ФУРАНА
- Просмотров: 11645
Хотя он менее реакционноспособен, чем пиррол в S E , он все же имеет проблемы с полигалогенированием, поэтому требуется использовать разбавленные галогены и при низких температурах. Также можно использовать NBS и NCS.
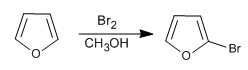
- Информация о материале
- Germán Fernández
- ТЕОРИЯ ПИРРОЛА, ТИОФЕНА И ФУРАНА
- Просмотров: 2680
а) Сульфирование фурана:
Фурансульфоны с комплексом SO 3 -Py
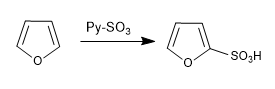
г) формулировка Вильсмейера
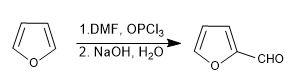
Подробнее: Сульфирование, формилирование, Манних и ацетилирование фурана
- Информация о материале
- Germán Fernández
- ТЕОРИЯ ПИРРОЛА, ТИОФЕНА И ФУРАНА
- Просмотров: 2541
Реагенты и условия реакции аналогичны используемым в пирроле.
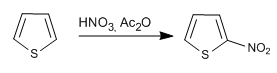
а) Нитрование тиофена
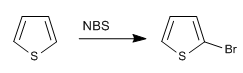
б) Галогенирование тиофена
- Информация о материале
- Germán Fernández
- ТЕОРИЯ ПИРРОЛА, ТИОФЕНА И ФУРАНА
- Просмотров: 2548
Пиррол, тиофен и фуран не подвергаются атаке нуклеофилов из-за сильной электронной плотности кольца (отличные р- системы). Поэтому реакции нуклеофильного присоединения, характерные для р- дефицитных систем, таких как пиридин, хинолин и изохинолин, не наблюдаются.
- Информация о материале
- Germán Fernández
- ТЕОРИЯ ПИРРОЛА, ТИОФЕНА И ФУРАНА
- Просмотров: 2859
Неспособность стабилизировать интермедиат, образующийся после нуклеофильной атаки, делает эту реакцию невозможной в 5-членных гетероциклах. Однако наличие дезактивирующих групп, присоединенных к кольцу, может компенсировать этот недостаток, позволяя протекать реакции.
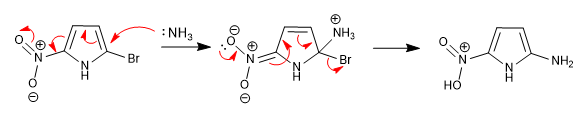
Нитро, расположенное в положении 5, позволяет делокализации заряда, образующегося на стадии добавления.
- Информация о материале
- Germán Fernández
- ТЕОРИЯ ПИРРОЛА, ТИОФЕНА И ФУРАНА
- Просмотров: 3264
Реакция галогенированных гетероциклов с металлоорганическими соединениями лития приводит к обмену галогена на металл с образованием нового металлоорганического соединения, которое позволяет атаковать широкий спектр электрофилов.
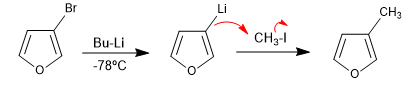
- Информация о материале
- Germán Fernández
- ТЕОРИЯ ПИРРОЛА, ТИОФЕНА И ФУРАНА
- Просмотров: 2447
Низкая ароматичность фурана позволяет ему участвовать в реакциях, разрушающих сопряжение кольца, таких как: Дильса-Альдера, 1,3-диполярная, фотохимическая и келотропная.
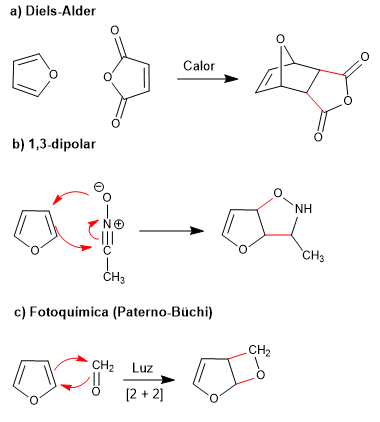
- Информация о материале
- Germán Fernández
- ТЕОРИЯ ПИРРОЛА, ТИОФЕНА И ФУРАНА
- Просмотров: 3133
а) Уходящая группа у ринга
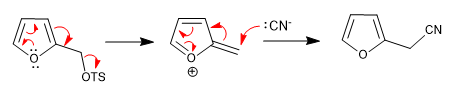
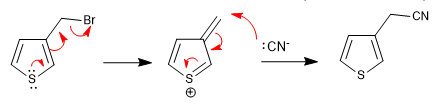
- Информация о материале
- Germán Fernández
- ТЕОРИЯ ПИРРОЛА, ТИОФЕНА И ФУРАНА
- Просмотров: 2462
Фуран раскрывается в водно-кислой среде с образованием 1,4-дикарбонилов. Реакция следует обратным стадиям синтеза Паала-Кнорра.
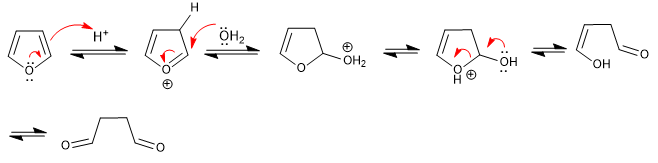
- Информация о материале
- Germán Fernández
- ТЕОРИЯ ПИРРОЛА, ТИОФЕНА И ФУРАНА
- Просмотров: 3762
Образует пирролы в результате реакции 1,4-дикарбонилов с аминами или аммиаком.
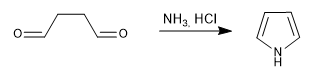
- Информация о материале
- Germán Fernández
- ТЕОРИЯ ПИРРОЛА, ТИОФЕНА И ФУРАНА
- Просмотров: 3511
Он состоит из реакции первичного амина с 3-кетоэфиром с образованием имина, который позже таутомеризуется в энамнин, атакуя α-галокетон. На последующей стадии циклизации получают пиррол.
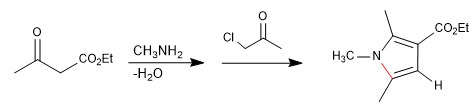
- Информация о материале
- Germán Fernández
- ТЕОРИЯ ПИРРОЛА, ТИОФЕНА И ФУРАНА
- Просмотров: 2563
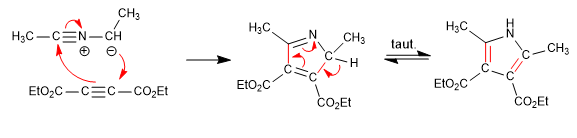
Илиды нитрила реагируют с алкинами посредством 1,3-диполярной реакции с образованием пирролов.