TEORIA DA QUINOLEÍNA E ISOQUINOLINA
- Detalhes
- Germán Fernández
- TEORIA DA QUINOLEÍNA E ISOQUINOLINA
- Acessos: 2497
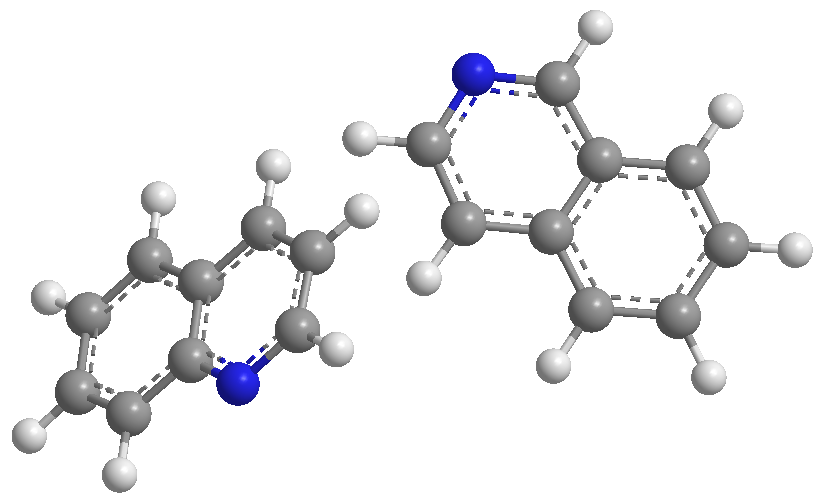
a) Basicidade
Quinolina e isoquinolina se comportam como bases através do par solitário de nitrogênio. Em meio ácido, eles são protonados para formar sais de quinolínio e isoquinolínio.
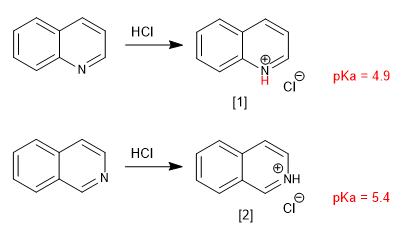
[1] Sal de quinolínio
[2] Sal de isoquiniolínio
Os substituintes modificam a basicidade de maneira análoga à piridina. Os grupos doadores aumentam a basicidade e os grupos atratores a diminuem.
Ler mais: Reações com par solitário de nitrogênio: quinolina e isoquinolina
- Detalhes
- Germán Fernández
- TEORIA DA QUINOLEÍNA E ISOQUINOLINA
- Acessos: 2520
A quinolina e a isoquinolina reagem com os eletrófilos através do anel benzênico (carbociclo), devido à sua maior riqueza eletrônica, em comparação com o anel piridínico. As posições mais favorecidas são 5 e 8.
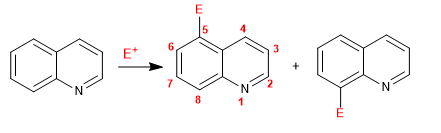
Ler mais: Reação de substituição eletrofílica em quinolina e isoquinolina
- Detalhes
- Germán Fernández
- TEORIA DA QUINOLEÍNA E ISOQUINOLINA
- Acessos: 2627
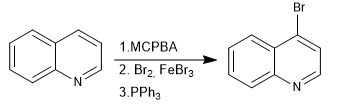
Os N-óxidos permitem que os eletrófilos sejam colocados na posição 4 da quinolina.
- Detalhes
- Germán Fernández
- TEORIA DA QUINOLEÍNA E ISOQUINOLINA
- Acessos: 2466
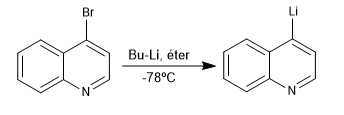
A reação entre derivados halogenados de quinolina e isoquinolina com organolíticos em baixa temperatura produz a troca de halogênio pelo metal, gerando novos organolíticos no anel.
- Detalhes
- Germán Fernández
- TEORIA DA QUINOLEÍNA E ISOQUINOLINA
- Acessos: 2655
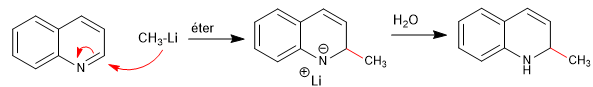
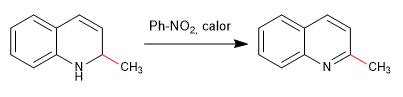
Os nucleófilos adicionam-se ao carbono 2 da quinolina, embora em certas condições também possa receber ataques ao seu carbono 4.
- Detalhes
- Germán Fernández
- TEORIA DA QUINOLEÍNA E ISOQUINOLINA
- Acessos: 2359
As quinolinas halogenadas na posição 2,4 sofrem muito facilmente reações de substituição nucleofílica. Por sua vez, a isoquinolina só pode dar esta reação na posição 1. Todos os nucleófilos com capacidade de dar S N 2 podem participar desta reação, nucleófilos ruins como água ou álcoois requerem entrada de calor.
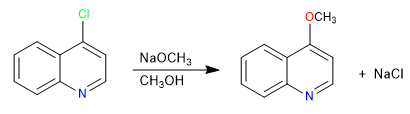
Ler mais: Substituição nucleofílica em quinolina e isoquinolina
- Detalhes
- Germán Fernández
- TEORIA DA QUINOLEÍNA E ISOQUINOLINA
- Acessos: 2402
Piridinas com grupos alquil na posição 2,4 possuem hidrogênios ácidos no carbono adjacente ao anel de piridina.
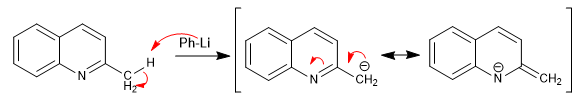
- Detalhes
- Germán Fernández
- TEORIA DA QUINOLEÍNA E ISOQUINOLINA
- Acessos: 29766
Na síntese de Skraup, a anilina [1] reage com carbonilas a,b -insaturadas em meio ácido para formar 1,2-dihidroquinolinas [3], que são transformadas em quinolinas por oxidação [4]. A carbonila a,b-insaturada pode ser obtida pela desidratação do 1,2,3-propanetrium [2].
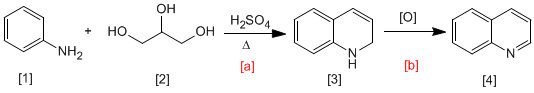
- Detalhes
- Germán Fernández
- TEORIA DA QUINOLEÍNA E ISOQUINOLINA
- Acessos: 7570
Na síntese de Conrad-Limpach, as quinolonas são obtidas pela reação da anilina com 3-cetoésteres. Em condições cinéticas obtém-se a 4-quinolona e em condições termodinâmicas a 2-quinolona.
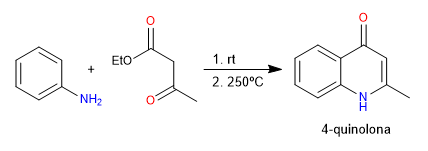
- Detalhes
- Germán Fernández
- TEORIA DA QUINOLEÍNA E ISOQUINOLINA
- Acessos: 2261
Na síntese de Combes, as quinolinas são obtidas pela reação da anilina com 1,3-dicarbonilas, na presença de catálise ácida. Numa primeira fase, forma-se a imina, que tautomeriza a enamina,a, ativando o anel aromático ao ceder o par de azoto. Na última etapa, a ciclização ocorre por ataque do benzeno à carbonila da cadeia
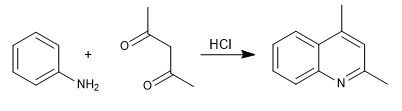
- Detalhes
- Germán Fernández
- TEORIA DA QUINOLEÍNA E ISOQUINOLINA
- Acessos: 2599
A síntese de Friedländer prepara quinolinas a partir de um nitrobenzeno orto-acetilado e uma cetona. A síntese começa com uma condensação aldólica em um meio básico. A redução do grupo nitro a amino permite a ciclização pela formação de imina.
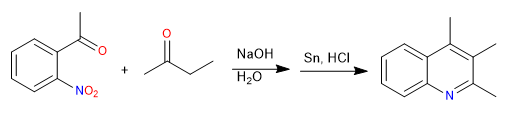
- Detalhes
- Germán Fernández
- TEORIA DA QUINOLEÍNA E ISOQUINOLINA
- Acessos: 2166
A reação entre 2-aminoetilbenzeno e um haleto de alcanoíla na presença de piridina forma uma amida. A amida é convertida no eletrófilo de Vilsmeier por reação com o oxitricloreto de fósforo. A ciclização é produzida por ataque do benzeno ao referido eletrófilo. Uma oxidação final gera isoquinolina.
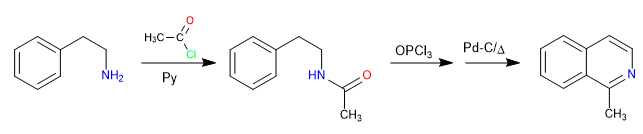
- Detalhes
- Germán Fernández
- TEORIA DA QUINOLEÍNA E ISOQUINOLINA
- Acessos: 2414
Pictet Spengler é uma reação do tipo Mannich. Na primeira etapa, o eletrófilo de Mannich é formado pela reação da amina com um aldeído em meio ácido clorídrico. Na etapa final, ocorre a ciclização por ataque do benzeno ao eletrófilo de Mannich. A isoquinolina é obtida após uma dupla oxidação.
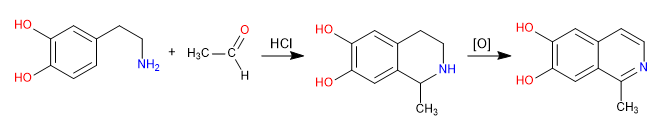
- Detalhes
- Germán Fernández
- TEORIA DA QUINOLEÍNA E ISOQUINOLINA
- Acessos: 2225
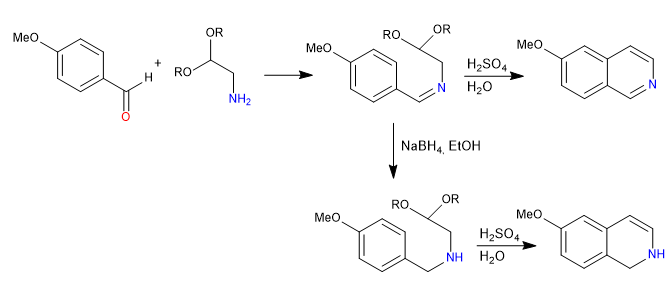
A síntese de Pomeranz-Fritsch prepara isoquinolinas pela reação de benzaldeídos com a-aminoaldeídos protegidos na forma de acetais. Em uma primeira etapa, a imina é formada pela reação entre o benzaldeído e a amina. Em uma segunda etapa, o acetal é quebrado com ácido sulfúrico aquoso, deixando livre o aldeído, que cicliza sob o ataque do benzeno.