PIROL, THIOPENA DAN TEORI FURAN
- Detail
- Germán Fernández
- PIROL, THIOPENA DAN TEORI FURAN
- Dilihat: 14756
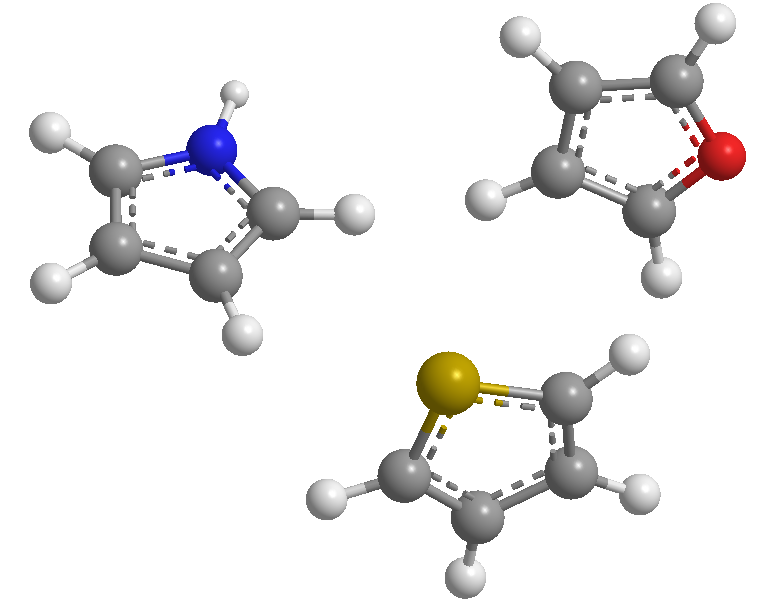
Ini adalah heterosiklik beranggota 5 yang heteroatomnya adalah nitrogen, belerang, dan oksigen. Mereka adalah sistem aromatik (mereka mematuhi aturan Huckel), dengan tiofena menjadi yang memiliki energi stabilisasi tertinggi (lebih aromatik), diikuti oleh pirol, dengan furan menjadi yang paling aromatik karena elektronegativitas oksigen yang kuat yang membuat delokalisasi oksigen menjadi sulit. .awan elektronik.
[1] Pirol
[2] Tiofena
[3] Furan
- Detail
- Germán Fernández
- PIROL, THIOPENA DAN TEORI FURAN
- Dilihat: 20490
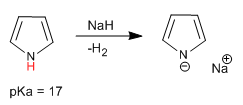
Pirol memiliki hidrogen asam pada atom nitrogen dengan pKa = 17. Dalam kasus tiofena dan furan, hidrogen asam terletak di posisi 2, meskipun memiliki keasaman yang jauh lebih rendah daripada pirola.
- Detail
- Germán Fernández
- PIROL, THIOPENA DAN TEORI FURAN
- Dilihat: 13074
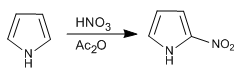
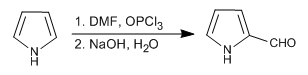
Dari tiga heterosiklik yang dipelajari dalam topik ini, pirol adalah yang paling reaktif dalam substitusi elektrofilik. Dalam media asam ia berpolimerisasi, nitrat dengan adanya asam nitrat dan anhidrida asetat, sulfon dengan kompleks piridin- SO3 , halogen dengan adanya larutan halogen encer pada suhu rendah dan menghasilkan reaksi Vilsmeier dan Mannich.
- Detail
- Germán Fernández
- PIROL, THIOPENA DAN TEORI FURAN
- Dilihat: 13061
Pirol dinitrasi dengan nitrat dalam anhidrida asetat karena campuran sulfonitrik menghasilkan polimerisasi.
- Detail
- Germán Fernández
- PIROL, THIOPENA DAN TEORI FURAN
- Dilihat: 12946
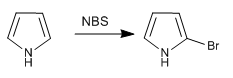
a) Halogenasi pirol
Untuk menghindari polihalogenasi, bekerja dengan halogen encer dan pada suhu rendah harus digunakan. Pilihan lainnya adalah menggunakan NBS atau NCS.
- Detail
- Germán Fernández
- PIROL, THIOPENA DAN TEORI FURAN
- Dilihat: 18678
- Detail
- Germán Fernández
- PIROL, THIOPENA DAN TEORI FURAN
- Dilihat: 12729
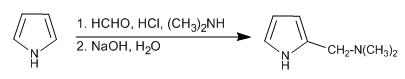
Reaksi Mannich memungkinkan penempatan gugus aminometil pada posisi 2 pirol.
- Detail
- Germán Fernández
- PIROL, THIOPENA DAN TEORI FURAN
- Dilihat: 10218
Dimungkinkan untuk menambahkan elektrofil ke posisi 3,4 pirol dengan menempatkan gugus besar pada atom nitrogen, sehingga posisi 2,5 dicegah. Salah satu gugus yang paling banyak digunakan adalah triisopropilsilil.
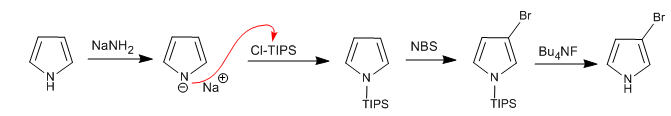
Selengkapnya: Substitusi elektrofilik pada posisi 3 pirol menggunakan Cl-TIPS
- Detail
- Germán Fernández
- PIROL, THIOPENA DAN TEORI FURAN
- Dilihat: 11869
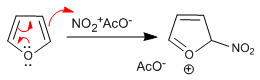
Furan nitra dengan asam nitrat dalam anhidrida asetat, bagaimanapun, karena aromatisitasnya yang rendah diserang oleh nukleofil dalam medium pada posisi 5 dan memerlukan tahap akhir perlakuan dasar atau pemanasan untuk mengembalikan aromatisitas.
Tahap 1. Pembangkitan elektrofit
![]()
Tahap 2. Serangan nukleofilik furan pada nitronium asetat
- Detail
- Germán Fernández
- PIROL, THIOPENA DAN TEORI FURAN
- Dilihat: 11264
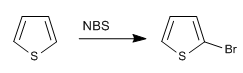
Meskipun kurang reaktif dibandingkan pirol di S E , ia masih memiliki masalah dengan polihalogenasi, sehingga diperlukan penggunaan halogen encer dan pada suhu rendah. NBS dan NCS juga bisa digunakan.
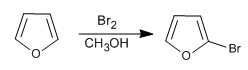
- Detail
- Germán Fernández
- PIROL, THIOPENA DAN TEORI FURAN
- Dilihat: 1894
a) Sulfonasi furan:
Sulfon furan dengan kompleks SO 3 -Py
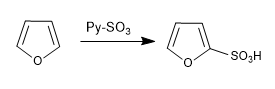
d) formulasi Vilsmeier
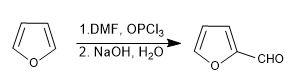
Selengkapnya: Sulfonasi, formilasi, Mannich dan asetilasi furan
- Detail
- Germán Fernández
- PIROL, THIOPENA DAN TEORI FURAN
- Dilihat: 2595
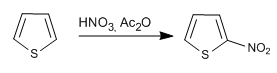
Reagen dan kondisi reaksi serupa dengan yang digunakan dalam pirol.
a) Nitrasi tiofena
b) Halogenasi tiofena
- Detail
- Germán Fernández
- PIROL, THIOPENA DAN TEORI FURAN
- Dilihat: 2195
Pyrrole, thiophene dan furan tidak diserang oleh nukleofil karena kerapatan elektron cincin yang kuat (excent p system). Oleh karena itu, reaksi adisi nukleofilik, karakteristik sistem defisien p seperti piridin, kuinolin, dan isokinolin, tidak teramati.
- Detail
- Germán Fernández
- PIROL, THIOPENA DAN TEORI FURAN
- Dilihat: 2325
Ketidakmampuan untuk menstabilkan zat antara yang terbentuk setelah serangan nukleofilik membuat reaksi ini tidak mungkin terjadi dalam heterosiklik beranggota 5. Namun, keberadaan gugus penonaktifan yang melekat pada cincin dapat menggantikan kekurangan ini, memungkinkan terjadinya reaksi.
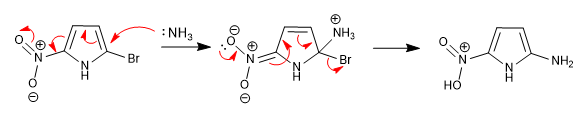
Nitro yang terletak di posisi 5 memungkinkan delokalisasi muatan yang dihasilkan selama tahap penambahan.
- Detail
- Germán Fernández
- PIROL, THIOPENA DAN TEORI FURAN
- Dilihat: 2436
Reaksi heterosiklik terhalogenasi dengan organologam litium menghasilkan pertukaran halogen dengan logam, menghasilkan organologam baru yang memungkinkan penyerangan berbagai macam elektrofil.
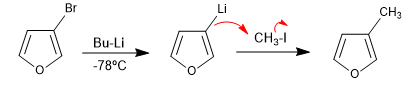
- Detail
- Germán Fernández
- PIROL, THIOPENA DAN TEORI FURAN
- Dilihat: 2452
Aromatisitas furan yang rendah memungkinkannya untuk berpartisipasi dalam reaksi yang menghancurkan konjugasi cincin, seperti: Diels-Alder, 1,3-dipolar, fotokimia dan kelotropik.
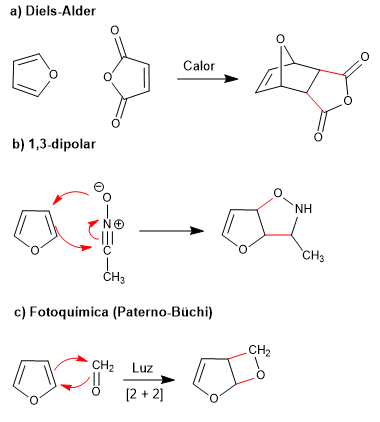
- Detail
- Germán Fernández
- PIROL, THIOPENA DAN TEORI FURAN
- Dilihat: 2300
a) Meninggalkan grup di dekat ring
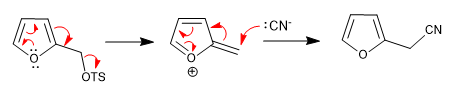
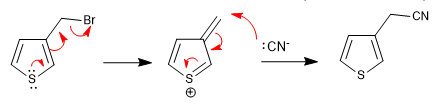
- Detail
- Germán Fernández
- PIROL, THIOPENA DAN TEORI FURAN
- Dilihat: 2150
Furan terbuka dalam media asam berair untuk membentuk 1,4-dikarbonil. Reaksi mengikuti langkah kebalikan dari sintesis Paal-Knorr.
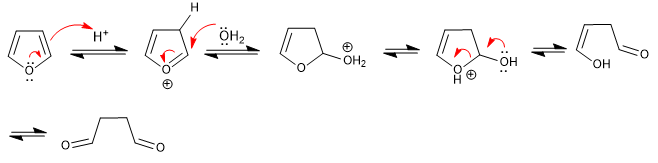
- Detail
- Germán Fernández
- PIROL, THIOPENA DAN TEORI FURAN
- Dilihat: 3424
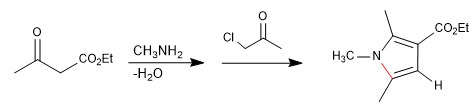
Menghasilkan pirol melalui reaksi 1,4-dikarbonil dengan amina atau amonia.
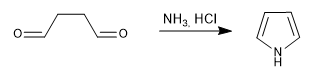
- Detail
- Germán Fernández
- PIROL, THIOPENA DAN TEORI FURAN
- Dilihat: 2446
Ini terdiri dari reaksi amina primer dengan 3-ketoester membentuk imina, yang kemudian mengalami tautomerisasi menjadi enamnin, menyerang a-haloketon. Pada tahap siklisasi berikutnya, pirol diperoleh.