TEORIA DA PIRIDINA
- Detalhes
- Germán Fernández
- TEORIA DA PIRIDINA
- Acessos: 14367
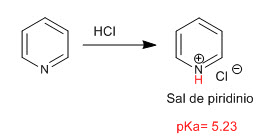
A piridina se comporta como uma base através do par solitário do átomo de nitrogênio. Na presença de ácidos, é protonado, gerando sais de piridínio.
- Detalhes
- Germán Fernández
- TEORIA DA PIRIDINA
- Acessos: 12192
a) Reação de alquilação
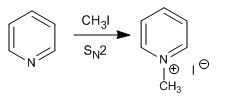
A piridina reage com haletos de alquila, haletos de alcanoíla e anidridos para formar sais de piridínio. A reação prossegue através do ataque nucleofílico do par solitário de nitrogênio ao carbono eletrofílico dos referidos reagentes.
- Detalhes
- Germán Fernández
- TEORIA DA PIRIDINA
- Acessos: 10630
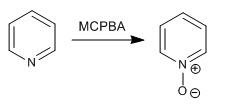
A piridina é oxidada na presença de peróxido de hidrogênio ou perácidos para formar N-óxidos de piridina.
- Detalhes
- Germán Fernández
- TEORIA DA PIRIDINA
- Acessos: 17915
O anel de piridina é capaz de atacar eletrófilos, de forma análoga ao benzeno, dando origem à reação de substituição eletrofílica aromática. Devido à eletronegatividade do nitrogênio, a piridina é muito menos reativa que o benzeno em SE, exigindo condições de reação mais drásticas.
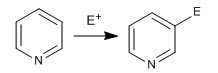
- Detalhes
- Germán Fernández
- TEORIA DA PIRIDINA
- Acessos: 2965
É possível colocar eletrófilos na posição 4 da piridina através da formação de N-óxidos.
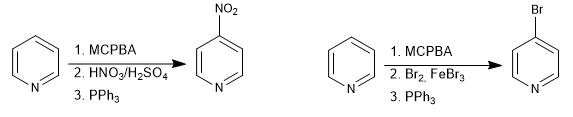
Ler mais: Substituição eletrofílica na posição 4 da piridina
- Detalhes
- Germán Fernández
- TEORIA DA PIRIDINA
- Acessos: 2807
Esta reação forma organolítios a partir de uma piridina halogenada. Organolíticos permitem o ataque de eletrófilos de carbono muito variados, tais como: haletos de alquila primários, aldeídos, cetonas, nitrilas, ésteres, epóxidos...
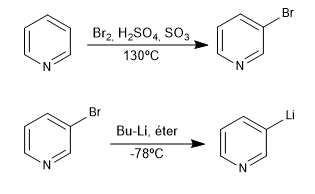
- Detalhes
- Germán Fernández
- TEORIA DA PIRIDINA
- Acessos: 2845
Nucleófilos duros (organometálicos, amida, hidreto de alumínio e lítio) atacam a posição 2 do anel de piridina, dando origem a reações de adição nucleofílica. Caso ocorra uma etapa final de oxidação, com perda de hidreto, podemos falar em substituição nucleofílica.
a) Adição de organometálicos
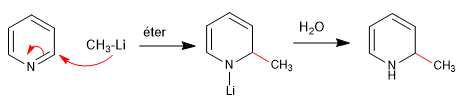
A rearomatização do anel é possível adicionando um oxidante que remove o "H 2 "
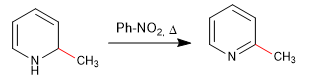
b) Adição de amida. reação de Chichibabin
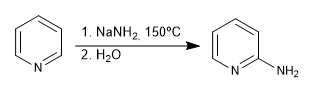
- Detalhes
- Germán Fernández
- TEORIA DA PIRIDINA
- Acessos: 3268
As piridinas com grupos abandonadores nas posições 2,4 reagem com nucleófilos, resultando na substituição do nucleófilo pelo grupo abandonante. A reação segue um mecanismo de adição-eliminação.
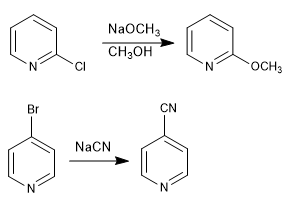
- Detalhes
- Germán Fernández
- TEORIA DA PIRIDINA
- Acessos: 3077
As piridinas com grupos abandonadores na posição 3 não dão substituições nucleofílicas, mas podem sofrer eliminação na presença de bases fortes, levando a um intermediário chamado piridina (equivalente ao benzino), que é atacado pelo nucleófilo do meio.
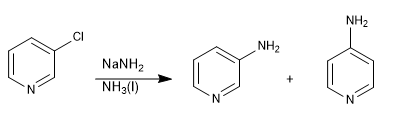
Ler mais: Substituição nucleofílica por adição-eliminação: a piridina
- Detalhes
- Germán Fernández
- TEORIA DA PIRIDINA
- Acessos: 2603
Piridinas com grupos 2,4-alquil têm hidrogênios ácidos na posição vizinha do anel. Esses hidrogênios podem ser removidos usando bases fortes como terc-butil-lítio, LDA, etc.
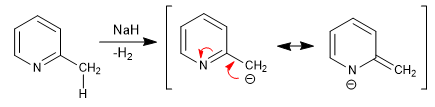
A base obtida possui um importante caráter nucleofílico, o que permite que a cadeia seja alongada atacando diferentes eletrófilos.
- Detalhes
- Germán Fernández
- TEORIA DA PIRIDINA
- Acessos: 17439
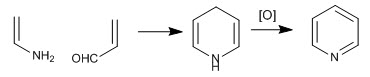
 A molécula de piridina pode ser obtida pela reação de enaminas com a,b-insaturadas. Assim, a reação entre etenamina e propenal, seguida de oxidação, produz piridina.
A molécula de piridina pode ser obtida pela reação de enaminas com a,b-insaturadas. Assim, a reação entre etenamina e propenal, seguida de oxidação, produz piridina.
- Detalhes
- Germán Fernández
- TEORIA DA PIRIDINA
- Acessos: 9074
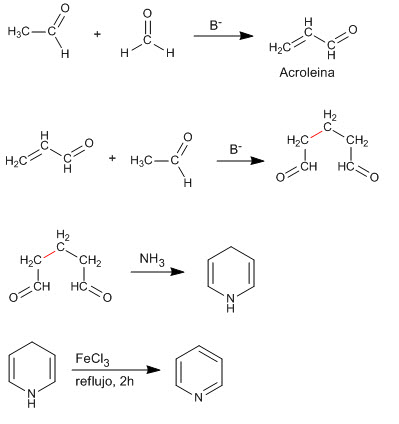
A condensação de duas moléculas de etanal e uma de metano produz um composto 1,5-dicarbonila que reage com a amônia para gerar piridina.
- Detalhes
- Germán Fernández
- TEORIA DA PIRIDINA
- Acessos: 2580
A síntese de Kröhnke de piridina começa a partir de um ileto de piridínio e um alfa, beta-insaturado para produzir 1,5-dicarbonil, que por reação com amônia dá a piridina final.
- Detalhes
- Germán Fernández
- TEORIA DA PIRIDINA
- Acessos: 2681
A síntese de Guareschi Thorpe prepara 2-piridonas a partir da cianoacetamida como componente nitrogenado, juntamente com uma 1,3-dicetona ou 3-cetoéster.