TEORIA DEL PIRROLO, DEL TIOFENE E DEI FURAN
- Dettagli
- Germán Fernández
- TEORIA DEL PIRROLO, DEL TIOFENE E DEI FURAN
- Visite: 14207
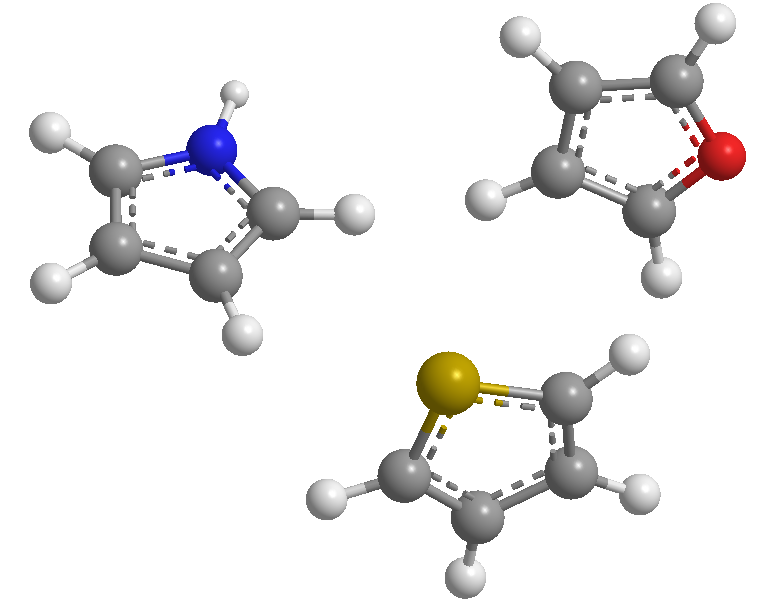
Questi sono eterocicli a 5 membri i cui eteroatomi sono azoto, zolfo e ossigeno. Sono sistemi aromatici (rispettano la regola di Hückel), dove il tiofene è quello con la più alta energia di stabilizzazione (più aromatico), seguito dal pirrolo, con il furano che è il meno aromatico a causa della forte elettronegatività dell'ossigeno che rende difficile la delocalizzazione dell'ossigeno la nuvola elettronica.
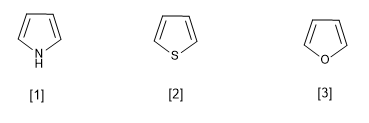
[1] Pirrolo
[2] Tiofene
[3] Furano
- Dettagli
- Germán Fernández
- TEORIA DEL PIRROLO, DEL TIOFENE E DEI FURAN
- Visite: 21058
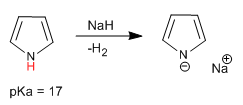
Il pirrolo ha un idrogeno acido sull'atomo di azoto con pKa = 17. Nel caso di tiofene e furano, gli idrogeni acidi si trovano in posizione 2, sebbene abbiano un'acidità molto inferiore rispetto al pirrolo.
Leggi tutto: Comportamento di base di pirrolo, tiofene e furano
- Dettagli
- Germán Fernández
- TEORIA DEL PIRROLO, DEL TIOFENE E DEI FURAN
- Visite: 14066
Dei tre eterocicli studiati in questo argomento, il pirrolo è il più reattivo nella sostituzione elettrofila. In ambiente acido polimerizza, nitra in presenza di acido nitrico e anidride acetica, solfone con il complesso piridina-SO 3 , alogeno in presenza di soluzioni alogene diluite a bassa temperatura e dà le reazioni di Vilsmeier e Mannich.
- Dettagli
- Germán Fernández
- TEORIA DEL PIRROLO, DEL TIOFENE E DEI FURAN
- Visite: 14802
Il pirrolo è nitrato con nitrico in anidride acetica poiché la miscela solfonitrica produce polimerizzazione.
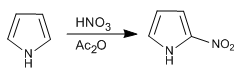
- Dettagli
- Germán Fernández
- TEORIA DEL PIRROLO, DEL TIOFENE E DEI FURAN
- Visite: 14619
a) Alogenazione del pirrolo
Per evitare la polialogenazione, si dovrebbe lavorare con alogeno diluito ea bassa temperatura. Un'altra opzione è utilizzare NBS o NCS.
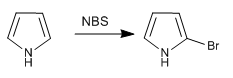
- Dettagli
- Germán Fernández
- TEORIA DEL PIRROLO, DEL TIOFENE E DEI FURAN
- Visite: 20402
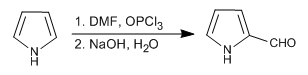
- Dettagli
- Germán Fernández
- TEORIA DEL PIRROLO, DEL TIOFENE E DEI FURAN
- Visite: 14611
La reazione di Mannich permette di posizionare il gruppo amminometilico in posizione 2 del pirrolo.
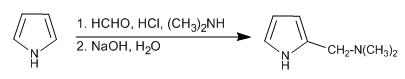
- Dettagli
- Germán Fernández
- TEORIA DEL PIRROLO, DEL TIOFENE E DEI FURAN
- Visite: 10817
È possibile aggiungere elettrofili alla posizione 3,4 del pirrolo posizionando gruppi voluminosi sull'atomo di azoto, in modo da impedire le posizioni 2,5. Uno dei gruppi più utilizzati è il triisopropilsilile.
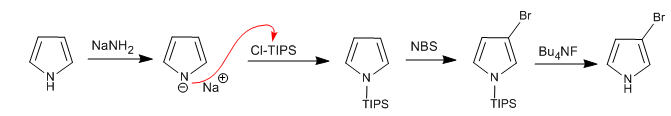
Leggi tutto: Sostituzione elettrofila in posizione 3 del pirrolo utilizzando Cl-TIPS
- Dettagli
- Germán Fernández
- TEORIA DEL PIRROLO, DEL TIOFENE E DEI FURAN
- Visite: 13311
Il furano nitro con acido nitrico in anidride acetica, invece, a causa della sua scarsa aromaticità, viene attaccato dai nucleofili nel mezzo in posizione 5 e richiede una fase finale di trattamento basico o riscaldamento per ripristinare l'aromaticità.
Fase 1. Generazione dell'elettrofita
![]()
Fase 2. Attacco nucleofilo di furano su acetato di nitronio
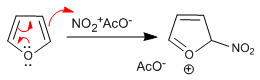
- Dettagli
- Germán Fernández
- TEORIA DEL PIRROLO, DEL TIOFENE E DEI FURAN
- Visite: 12325
Sebbene sia meno reattivo del pirrolo in SE , ha ancora problemi con le polialogenazioni, quindi è necessario utilizzare alogeni diluiti ea basse temperature. Possono essere utilizzati anche NBS e NCS.
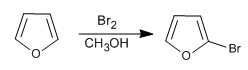
- Dettagli
- Germán Fernández
- TEORIA DEL PIRROLO, DEL TIOFENE E DEI FURAN
- Visite: 2735
a) Solfonazione del furano:
I furan sulfoni con il complesso SO3 -Py
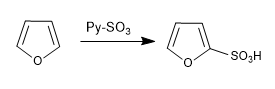
d) Formulazione di Vilsmeier
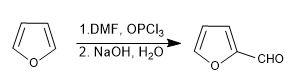
Leggi tutto: Solfonazione, formilazione, Mannich e acetilazione del furano
- Dettagli
- Germán Fernández
- TEORIA DEL PIRROLO, DEL TIOFENE E DEI FURAN
- Visite: 2738
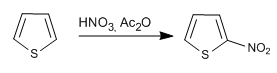
I reagenti e le condizioni di reazione sono simili a quelli usati nel pirrolo.
a) Nitrazione del tiofene
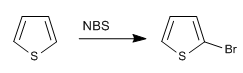
b) Alogenazione del tiofene
- Dettagli
- Germán Fernández
- TEORIA DEL PIRROLO, DEL TIOFENE E DEI FURAN
- Visite: 2207
Pirrolo, tiofene e furano non vengono attaccati dai nucleofili a causa della forte densità elettronica dell'anello (excent p systems). Pertanto, non si osservano reazioni di addizione nucleofila, caratteristiche di sistemi p-carenti come piridina, chinolina e isochinolina.
- Dettagli
- Germán Fernández
- TEORIA DEL PIRROLO, DEL TIOFENE E DEI FURAN
- Visite: 2824
L'incapacità di stabilizzare l'intermedio formatosi dopo l'attacco nucleofilo rende questa reazione impossibile negli eterocicli a 5 membri. Tuttavia, la presenza di gruppi disattivanti attaccati all'anello può sopperire a questa carenza, permettendo la reazione.
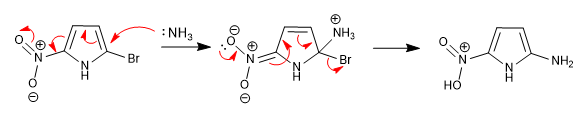
Il nitro posto in posizione 5 permette la delocalizzazione della carica generata durante la fase di addizione.
- Dettagli
- Germán Fernández
- TEORIA DEL PIRROLO, DEL TIOFENE E DEI FURAN
- Visite: 3434
La reazione di eterocicli alogenati con organometallici di litio produce lo scambio di alogeno per il metallo, generando un nuovo organometallico che consente di attaccare un'ampia varietà di elettrofili.
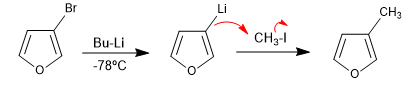
- Dettagli
- Germán Fernández
- TEORIA DEL PIRROLO, DEL TIOFENE E DEI FURAN
- Visite: 2978
La bassa aromaticità del furano gli consente di partecipare a reazioni che distruggono la coniugazione dell'anello, come: Diels-Alder, 1,3-dipolare, fotochimico e chelotropico.
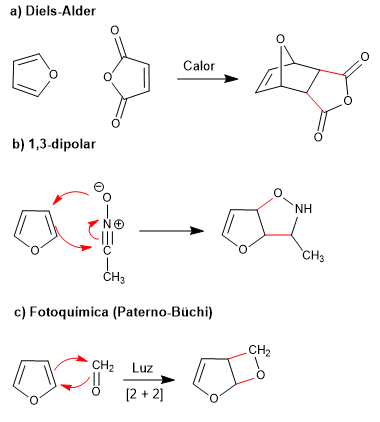
- Dettagli
- Germán Fernández
- TEORIA DEL PIRROLO, DEL TIOFENE E DEI FURAN
- Visite: 2530
a) Gruppo in partenza vicino al ring
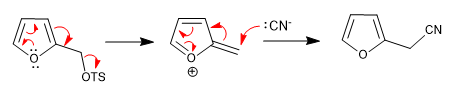
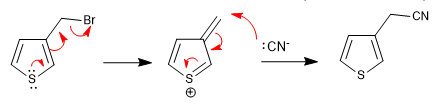
- Dettagli
- Germán Fernández
- TEORIA DEL PIRROLO, DEL TIOFENE E DEI FURAN
- Visite: 3367
Il furano si apre in mezzi acidi acquosi per formare 1,4-dicarbonili. La reazione segue le fasi inverse della sintesi di Paal-Knorr.
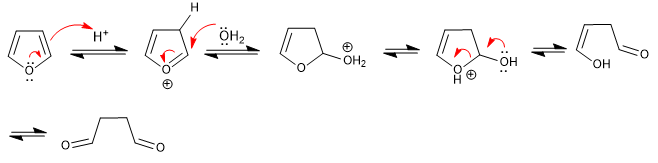
- Dettagli
- Germán Fernández
- TEORIA DEL PIRROLO, DEL TIOFENE E DEI FURAN
- Visite: 5001
Genera pirroli per reazione di 1,4-dicarbonili con ammine o ammoniaca.
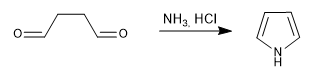
- Dettagli
- Germán Fernández
- TEORIA DEL PIRROLO, DEL TIOFENE E DEI FURAN
- Visite: 4993
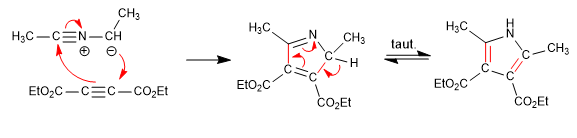
Consiste nella reazione di un'ammina primaria con un 3-chetoestere che forma un'immina, che successivamente tautomerizza a enamnina, attaccando un a-alochetone. In una successiva fase di ciclizzazione si ottiene il pirrolo.
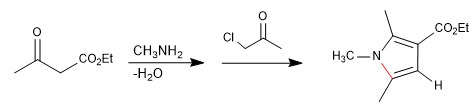
- Dettagli
- Germán Fernández
- TEORIA DEL PIRROLO, DEL TIOFENE E DEI FURAN
- Visite: 2452
Le ilidi nitriliche reagiscono con gli alchini, tramite la reazione 1,3-dipolare, per generare pirroli