HETEROCICLOS - AROMATICIDADE
- Detalhes
- Germán Fernández
- HETEROCICLOS - AROMATICIDADE
- Acessos: 1247
- Detalhes
- Germán Fernández
- HETEROCICLOS - AROMATICIDADE
- Acessos: 2520
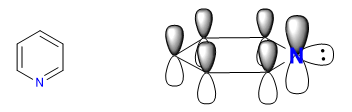
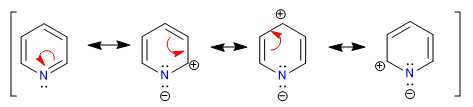
A) Heterociclos com 6 átomos e 6 elétrons p .
- Detalhes
- Germán Fernández
- HETEROCICLOS - AROMATICIDADE
- Acessos: 1562
Existem vários critérios para determinar o grau de aromaticidade de um heterociclo:
A) Comprimentos de ligação.
Um heterociclo é tanto mais aromático quanto menor for a diferença entre os comprimentos das diferentes ligações que compõem o anel. O benzeno tem o mesmo comprimento em todas as suas ligações carbono-carbono, o que o torna o composto mais aromático. Os heterociclos apresentam diferenças nas distâncias de ligação, sendo menos aromáticos quanto maiores forem essas diferenças.
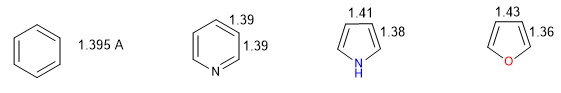
Todas as ligações CC no benzeno medem 1,395 A, uma distância de ligação intermediária entre ligações simples (1,48 A) e duplas (1,34 A). No furano há uma diferença notável entre o comprimento das ligações, indicando uma aromaticidade menor do que no pirrol. A piridina, por outro lado, possui distâncias de ligação CC muito semelhantes entre si e semelhantes às do benzeno, que apresenta maior aromaticidade que o pirrol ou o furano.
Ler mais: Critérios para determinar a aromaticidade em heterociclos
- Detalhes
- Germán Fernández
- HETEROCICLOS - AROMATICIDADE
- Acessos: 1614
Os heteroaromáticos de 6 membros possuindo grupos -OH ou -SH nas posições 2,4 existem preferencialmente em solução nas formas ceto ou tioceto. Em solução, os compostos com grupos amino nas posições 2,4 existem preferencialmente na forma amino, em vez de como um tautômero imino.
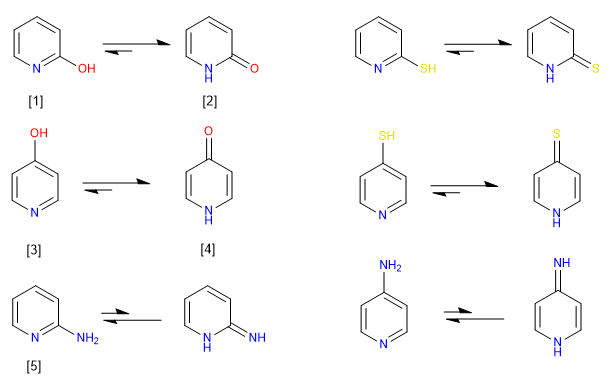
[1] 2-Hidroxipiridina
[2] 2-Piridona
[3] 4-Hidroxipiridina
[4] 4-Piridona
[5] 2-Aminopiridina
- Detalhes
- Germán Fernández
- HETEROCICLOS - AROMATICIDADE
- Acessos: 1465
Nesta seção vamos estudar a influência das tensões anulares nas propriedades dos heterociclos.
A) Tensão angular em pequenos heterociclos (3 e 4 barras).
Os ângulos naturais de ligação de um carbono sp 3 são 109,5o, porém em ciclos de três membros esse ângulo diminui para 60o, o que produz uma enorme tensão. Para aliviar essa tensão, as ligações entre os carbonos deixam de ser retas, dobrando-se, dando origem a ligações curvas chamadas de “ligações banana”. Os ângulos formados por essas ligações são de 104º, uma discrepância mais tolerável.
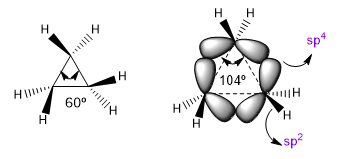
| Hibridação | ângulo de ligação |
| sp sp 2 sp 3 sp 4 | 180º 120º 109,5º 104º |
- Detalhes
- Germán Fernández
- HETEROCICLOS - AROMATICIDADE
- Acessos: 2213
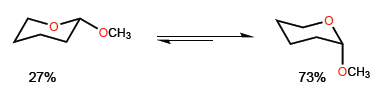
O fenômeno pelo qual a conformação axial de um heterociclo substituído na posição 2 é estabilizado é chamado de efeito anomérico.Por exemplo, o 2-metoxioxano apresenta uma proporção de 27:73 a favor da conformação com metóxido na posição axial.