SINTESI DI ETEROCICLI (I)
- Dettagli
- Germán Fernández
- SINTESI DI ETEROCICLI (I)
- Visite: 1283

In questo argomento studieremo reazioni in cui gli eterocicli sono generati da reazioni di ciclizzazione. La formazione di un ciclo può avvenire a partire da una molecola che contiene un centro nucleofilo ed un altro elettrofilo, che si uniscono formando un legame. Ma i cicli si possono ottenere anche da due molecole, in questo caso sono necessari due centri nucleofili in una di esse e due centri elettrofili nell'altra, oppure ciascuna contiene un elettrolilo e un centro nucleofilo. Quando si parla di centro nucleofilo, ci si riferisce solitamente ad un atomo con coppie solitarie e capace di attaccare un centro di polarità positiva (elettrofilo) che si può trovare nella stessa molecola o in un'altra.
- Dettagli
- Germán Fernández
- SINTESI DI ETEROCICLI (I)
- Visite: 1554
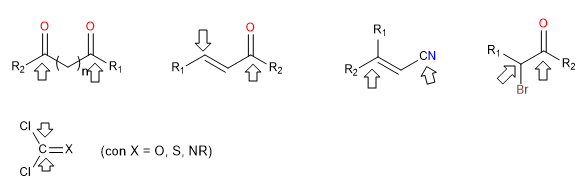
i) Reagenti doppiamente elettrofili
Sono reagenti che hanno due posizioni con una forte polarità positiva a cui attaccano i nucleofili. Questi reagenti formano cicli se confrontati con altri che sono doppiamente nucleofili. Questi sono carbonili dicarbonili, alfa, beta-insaturi, alfa-alogenati.
- Dettagli
- Germán Fernández
- SINTESI DI ETEROCICLI (I)
- Visite: 2524
Gli attacchi nucleofili sono classificati in base all'ibridazione del centro elettrofilo (tet (sp3), trig (sp2) e dig (sp). E nelle chiusure eso ed endo dell'anello, a seconda che il legame si sia rotto durante la chiusura dell'anello è all'interno (endo) o all'esterno (exo) dell'anello che si forma.
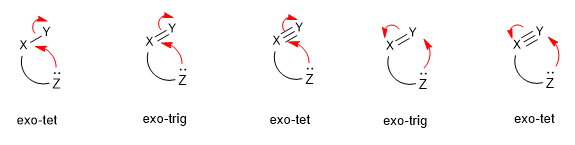
Leggi tutto: Classificazione degli attacchi nucleofili (regole di Baldwin)
- Dettagli
- Germán Fernández
- SINTESI DI ETEROCICLI (I)
- Visite: 2100
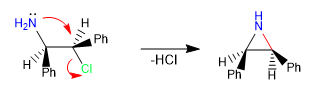
Le reazioni intramolecolari di tipo SN2 sono un potente strumento per formare cicli a 5, 6 e 3 membri, risultando lente nelle ciclizzazioni a 4 e 7 membri. Si tratta di reazioni concertate e stereospecifiche, che ne aumentano ulteriormente il valore sintetico.
i) Formazione di aziridina.
- Dettagli
- Germán Fernández
- SINTESI DI ETEROCICLI (I)
- Visite: 2196
In questa sezione vedremo esempi di sintesi di eterocicli mediante attacco nucleofilo a gruppi carbonilici. I carbonili aldeidici e chetonici danno luogo a reazioni di addizione nucleofila, mentre i carbonili di derivati acidi (alogenuri, anidridi, esteri, ammidi, nitrili) danno luogo a processi di addizione-eliminazione.
A) Iniziamo con la sintesi di un benzofurano.
Nella prima fase uniamo i reagenti per mezzo di un SN2 e finiamo per ciclare con una reazione aldolica.
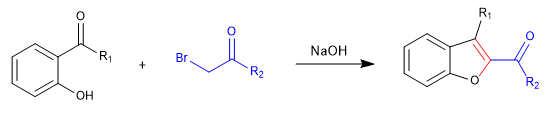
Meccanismo:
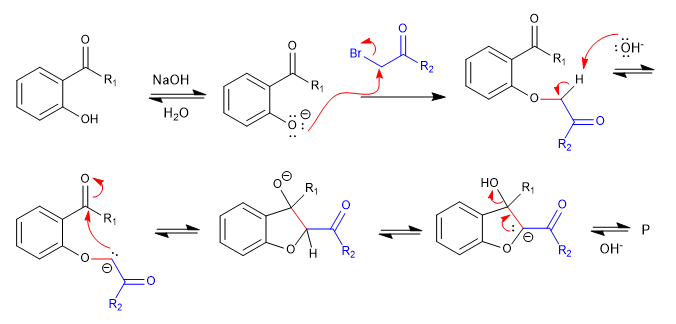
- Dettagli
- Germán Fernández
- SINTESI DI ETEROCICLI (I)
- Visite: 1498
Alchini e nitrili partecipano come elettrofili a numerose reazioni di sintesi di eterocicli, essendo attaccati da un'ampia varietà di nucleofili.
A) Il carattere nucleofilo-elettrofilo del propanedinitrile e degli alfa-amminochetoni permette la preparazione dei pirroli , vediamo un esempio.
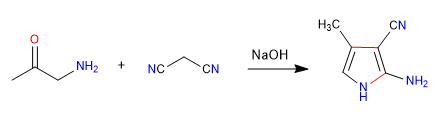
Meccanismo:
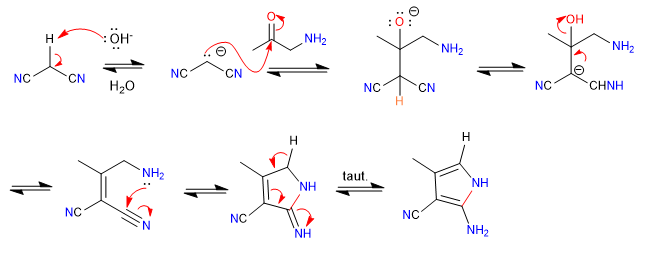
- Dettagli
- Germán Fernández
- SINTESI DI ETEROCICLI (I)
- Visite: 1619
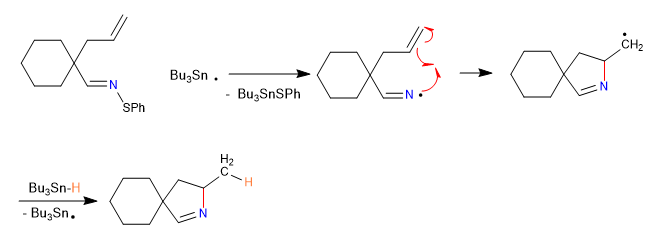
In questa sezione vedremo esempi di ciclizzazioni che avvengono tramite intermedi di tipo radicalico, carbene o nitrene.
A) Iniziamo con una ciclizzazione radicale, che usa il tributilstagno idruro come reagente ed è iniziata da AIBN
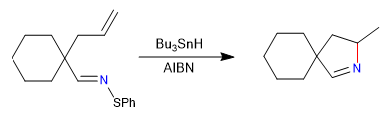
Meccanismo:
1. iniziazione
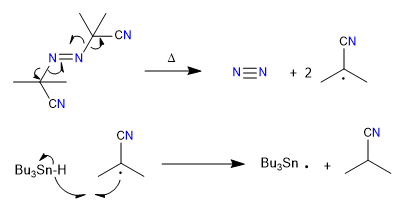
2. Propagazione