ETEROCICLI - AROMATICITÀ
- Dettagli
- Germán Fernández
- ETEROCICLI - AROMATICITÀ
- Visite: 1285
- Dettagli
- Germán Fernández
- ETEROCICLI - AROMATICITÀ
- Visite: 1517
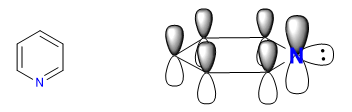
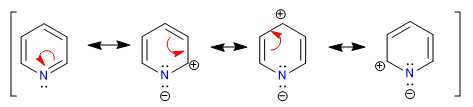
A) Eterocicli con 6 atomi e 6 p elettroni.
- Dettagli
- Germán Fernández
- ETEROCICLI - AROMATICITÀ
- Visite: 1774
Esistono diversi criteri per determinare il grado di aromaticità di un eterociclo:
A) Lunghezze dei collegamenti.
Un eterociclo è tanto più aromatico quanto minore è la differenza tra le lunghezze dei diversi legami che compongono l'anello. Il benzene ha la stessa lunghezza in tutti i suoi legami carbonio-carbonio, il che lo rende il composto più aromatico. Gli eterocicli presentano differenze nelle distanze di legame, essendo meno aromatici quanto maggiori sono queste differenze.
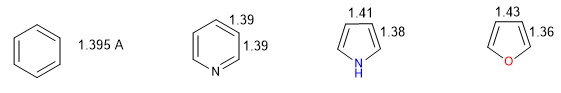
Tutti i legami CC nel benzene misurano 1,395 A, una distanza di legame intermedia tra legami singoli (1,48 A) e doppi (1,34 A). Nel furano c'è una notevole differenza nella lunghezza dei legami, indice di un'aromaticità inferiore rispetto al pirrolo. La piridina, invece, ha tra loro distanze di legame CC molto simili e simili a quelle del benzene, che mostra una maggiore aromaticità rispetto al pirrolo o al furano.
Leggi tutto: Criteri per la determinazione dell'aromaticità negli eterocicli
- Dettagli
- Germán Fernández
- ETEROCICLI - AROMATICITÀ
- Visite: 2289
Gli eteroaromatici a 6 membri che possiedono gruppi -OH o -SH in posizioni 2,4 esistono preferenzialmente in soluzione nelle forme cheto o tiocheto. In soluzione, i composti con gruppi amminici in posizioni 2,4 esistono preferenzialmente nella forma amminica, piuttosto che come tautomero immino.
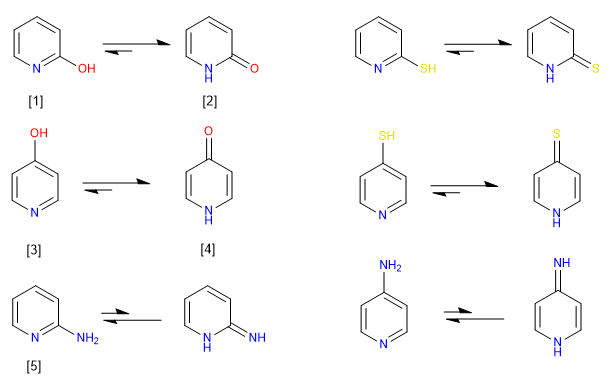
[1] 2-Idrossipiridina
[2] 2-Piridone
[3] 4-Idrossipiridina
[4] 4-Piridone
[5] 2-Amminopiridina
- Dettagli
- Germán Fernández
- ETEROCICLI - AROMATICITÀ
- Visite: 1480
In questa sezione studieremo l'influenza delle sollecitazioni anulari sulle proprietà degli eterocicli.
A) Sforzo angolare in piccoli eterocicli (3 e 4 membri).
Gli angoli di legame naturali di un carbonio sp3 sono 109,5º, tuttavia nei cicli a tre membri questo angolo diminuisce a 60º, il che produce un'enorme tensione. Per alleviare questa tensione, i legami tra i carboni non sono più diritti, piegandosi, dando origine a legami curvi chiamati "legami a banana". Gli angoli formati da questi legami sono di 104°, una discrepanza più tollerabile.
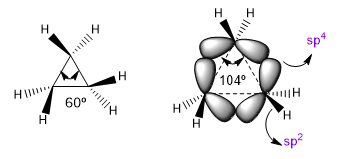
| Ibridazione | Angolo di legame |
| sp sp2 sp3 sp4 |
180º 120º 109,5º 104º |
- Dettagli
- Germán Fernández
- ETEROCICLI - AROMATICITÀ
- Visite: 3397
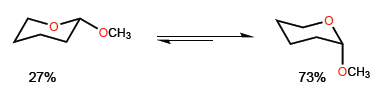
Si chiama effetto anomerico il fenomeno per cui viene stabilizzata la conformazione assiale di un eterociclo sostituito in posizione 2. Ad esempio, il 2-metossiossano presenta un rapporto 27:73 a favore della conformazione con metossido in posizione assiale.