SYNTHESE VON HETEROCYKLEN (I)
- Details
- Germán Fernández
- SYNTHESE VON HETEROCYKLEN (I)
- Zugriffe: 1323

In diesem Thema werden wir Reaktionen untersuchen, bei denen Heterocyclen durch Cyclisierungsreaktionen erzeugt werden. Die Bildung eines Zyklus kann aus einem Molekül erfolgen, das ein nukleophiles Zentrum und ein weiteres elektrophiles Zentrum enthält, die sich zu einer Bindung verbinden. Es können aber auch Zyklen aus zwei Molekülen erhalten werden, in diesem Fall sind in einem von ihnen zwei nukleophile Zentren und in dem anderen zwei elektrophile Zentren notwendig, oder jedes enthält ein elektrolytisches und ein nukleophiles Zentrum. Wenn wir von einem nukleophilen Zentrum sprechen, beziehen wir uns normalerweise auf ein Atom mit freien Elektronenpaaren, das in der Lage ist, ein Zentrum mit positiver Polarität (Elektrophil) anzugreifen, das sich im selben Molekül oder in einem anderen befindet.
- Details
- Germán Fernández
- SYNTHESE VON HETEROCYKLEN (I)
- Zugriffe: 1555
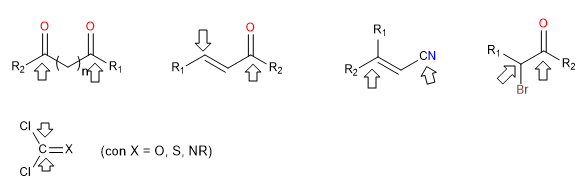
i) Doppelt elektrophile Reagenzien
Sie sind Reagenzien, die zwei Positionen mit stark positiver Polarität haben, an denen Nucleophile angreifen. Diese Reagenzien bilden Zyklen, wenn sie anderen gegenübergestellt werden, die doppelt nukleophil sind. Dies sind Dicarbonyle, alpha, beta-ungesättigte, alpha-halogenierte Carbonyle.
- Details
- Germán Fernández
- SYNTHESE VON HETEROCYKLEN (I)
- Zugriffe: 2447
Nucleophile Angriffe werden anhand der Hybridisierung des elektrophilen Zentrums (tet (sp 3 ), trig (sp 2 ) und dig (sp)) sowie in exo- und endo-Ringschlüsse eingeteilt, je nachdem, ob die Bindung beim Ringschluss gebrochen wird innerhalb (endo) oder außerhalb (exo) des sich bildenden Rings liegt.
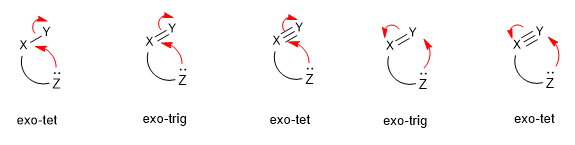
Weiterlesen: Klassifizierung nukleophiler Angriffe (Baldwin-Regeln)
- Details
- Germán Fernández
- SYNTHESE VON HETEROCYKLEN (I)
- Zugriffe: 1634
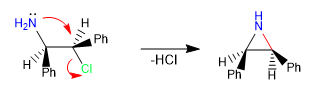
Intramolekulare Reaktionen vom S N 2-Typ sind ein leistungsfähiges Werkzeug zur Bildung von 5-, 6- und 3-gliedrigen Zyklen, was zu langsamen 4- und 7-gliedrigen Cyclisierungen führt. Dies sind konzertierte und stereospezifische Reaktionen, was ihren synthetischen Wert weiter erhöht.
i) Bildung von Aziridin.
- Details
- Germán Fernández
- SYNTHESE VON HETEROCYKLEN (I)
- Zugriffe: 1840
In diesem Abschnitt sehen wir Beispiele für die Synthese von Heterocyclen durch nucleophilen Angriff auf Carbonylgruppen. Aldehyd- und Ketoncarbonyle führen zu nucleophilen Additionsreaktionen, während Carbonyle von Säurederivaten (Halogenide, Anhydride, Ester, Amide, Nitrile) zu Additions-Eliminierungs-Prozessen führen.
A) Wir beginnen mit der Synthese eines Benzofurans.
In der ersten Stufe verbinden wir die Reaktanten über ein S N 2 und führen schließlich zu einer Aldolreaktion.
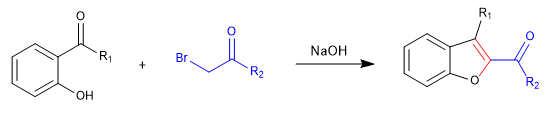
Mechanismus:
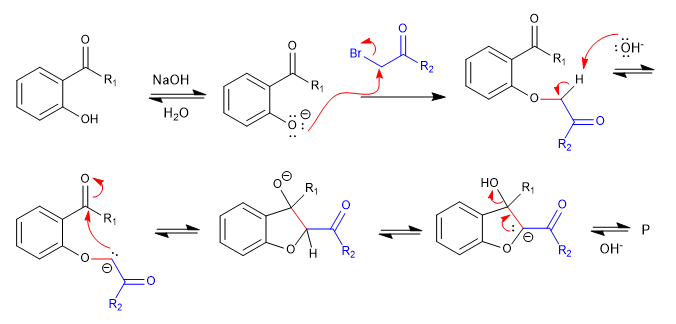
Weiterlesen: Cyclisierungsprozesse durch nukleophile Addition und Additions-Eliminierung an...
- Details
- Germán Fernández
- SYNTHESE VON HETEROCYKLEN (I)
- Zugriffe: 1575
Alkine und Nitrile nehmen als Elektrophile an zahlreichen Heterocyclen-Synthesereaktionen teil und werden von einer Vielzahl von Nucleophilen angegriffen.
A) Der nukleophil-elektrophile Charakter von Propandinitril und alpha-Aminoketonen ermöglicht die Herstellung von Pyrrolen , sehen wir uns ein Beispiel an.
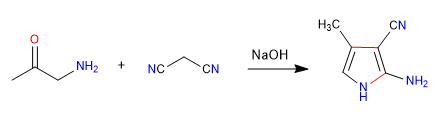
Mechanismus:
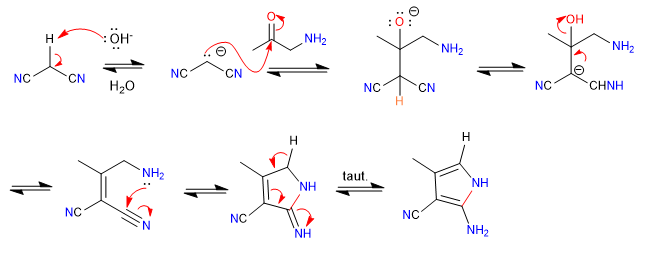
- Details
- Germán Fernández
- SYNTHESE VON HETEROCYKLEN (I)
- Zugriffe: 1516
In diesem Abschnitt sehen wir Beispiele für Cyclisierungen, die über Zwischenprodukte vom Radikaltyp, Carben oder Nitren, stattfinden.
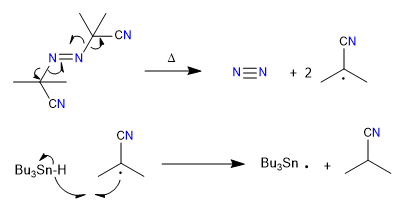
A) Wir beginnen mit einer radikalischen Cyclisierung, die Tributylzinnhydrid als Reagenz verwendet und durch AIBN initiiert wird
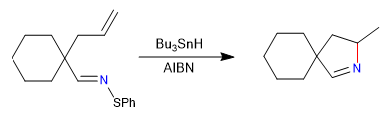
Mechanismus:
1. Einleitung
2. Ausbreitung
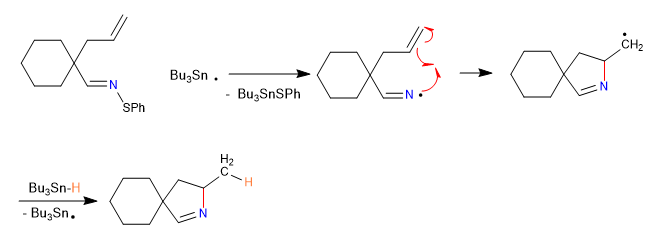
Weiterlesen: Cyclisierung von Carbenen, Nitrenen und Radikalen