TEORIA DELLA PIRIDINA
- Dettagli
- Germán Fernández
- TEORIA DELLA PIRIDINA
- Visite: 14497
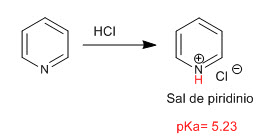
La piridina si comporta come una base attraverso la coppia solitaria dell'atomo di azoto. In presenza di acidi, viene protonato, generando sali di piridinio.
- Dettagli
- Germán Fernández
- TEORIA DELLA PIRIDINA
- Visite: 13358
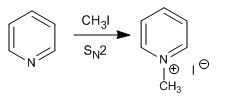
a) Reazione di alchilazione
La piridina reagisce con alogenuri alchilici, alogenuri alcanoilici e anidridi per formare sali di piridinio. La reazione procede attraverso l'attacco nucleofilo del lone pair dell'azoto sul carbonio elettrofilo di detti reagenti.
- Dettagli
- Germán Fernández
- TEORIA DELLA PIRIDINA
- Visite: 11809
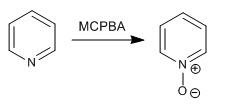
La piridina viene ossidata in presenza di perossido di idrogeno o peracidi per formare piridina N-ossidi.
- Dettagli
- Germán Fernández
- TEORIA DELLA PIRIDINA
- Visite: 18443
L'anello piridinico è in grado di attaccare gli elettrofili, analogamente al benzene, dando la reazione di sostituzione elettrofila aromatica. A causa dell'elettronegatività dell'azoto, la piridina è molto meno reattiva del benzene in SE, richiedendo condizioni di reazione più drastiche.
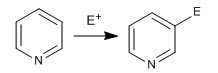
- Dettagli
- Germán Fernández
- TEORIA DELLA PIRIDINA
- Visite: 2689
È possibile posizionare gli elettrofili nella posizione 4 della piridina attraverso la formazione di N-ossidi.
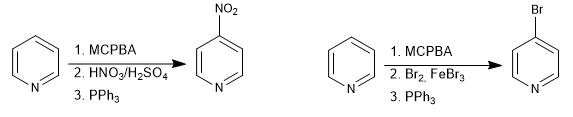
Leggi tutto: Sostituzione elettrofila in posizione 4 della piridina
- Dettagli
- Germán Fernández
- TEORIA DELLA PIRIDINA
- Visite: 3007
Questa reazione forma organolitio da una piridina alogenata. Gli organolitici consentono l'attacco di elettrofili di carbonio molto vari, come: alogenuri alchilici primari, aldeidi, chetoni, nitrili, esteri, epossidi...
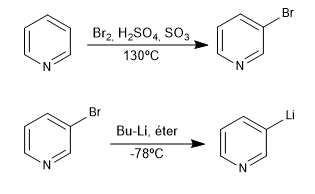
- Dettagli
- Germán Fernández
- TEORIA DELLA PIRIDINA
- Visite: 2703
I nucleofili duri (organometallici, ammidici, litio alluminio idruro) attaccano la posizione 2 dell'anello piridinico, dando luogo a reazioni di addizione nucleofila. Nel caso in cui si verifichi uno stadio finale di ossidazione, con perdita di idruro, si può parlare di sostituzione nucleofila.
a) Addizione di organometallici
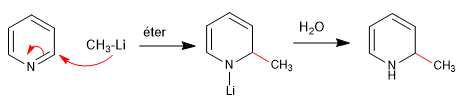
La riromatizzazione dell'anello è possibile aggiungendo un ossidante che rimuove "H 2 "
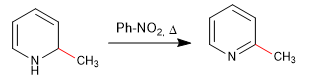
b) Addizione di ammide. La reazione di Chichibabin
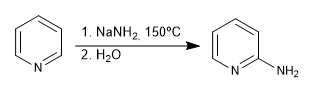
- Dettagli
- Germán Fernández
- TEORIA DELLA PIRIDINA
- Visite: 3305
Le piridine con gruppi uscenti nelle posizioni 2,4 reagiscono con i nucleofili, determinando la sostituzione del gruppo uscente con il nucleofilo. La reazione segue un meccanismo di addizione-eliminazione.
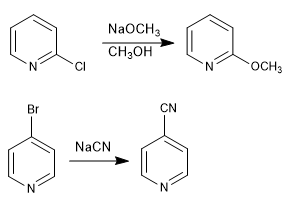
Leggi tutto: Reazioni di sostituzione nucleofila in piridina
- Dettagli
- Germán Fernández
- TEORIA DELLA PIRIDINA
- Visite: 2755
Le piridine con gruppi uscenti in posizione 3 non danno sostituzioni nucleofile, ma possono subire l'eliminazione in presenza di basi forti, portando a un intermedio chiamato piridina (equivalente al benzino), che viene attaccato dal nucleofilo nel mezzo.
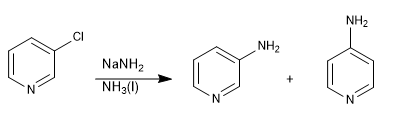
Leggi tutto: Sostituzione nucleofila per eliminazione-addizione: la piridina
- Dettagli
- Germán Fernández
- TEORIA DELLA PIRIDINA
- Visite: 2413
Le piridine con gruppi 2,4-alchilici hanno idrogeni acidi nella posizione vicina dell'anello. Questi idrogeni possono essere rimossi utilizzando basi forti come terz-butillitio, LDA, ecc.
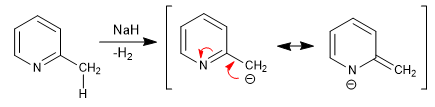
La base ottenuta ha un importante carattere nucleofilo, che permette di allungare la catena attaccando diversi elettrofili.
- Dettagli
- Germán Fernández
- TEORIA DELLA PIRIDINA
- Visite: 21525
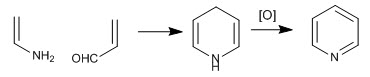
 La molecola di piridina può essere ottenuta facendo reagire enammine con a, b-insaturo. Pertanto, la reazione tra etenammina e propenale, seguita dall'ossidazione, produce piridina.
La molecola di piridina può essere ottenuta facendo reagire enammine con a, b-insaturo. Pertanto, la reazione tra etenammina e propenale, seguita dall'ossidazione, produce piridina.
- Dettagli
- Germán Fernández
- TEORIA DELLA PIRIDINA
- Visite: 10401
La condensazione di due molecole di etanale e una di metano produce un composto 1,5-dicarbonilico che reagisce con l'ammoniaca per generare piridina.
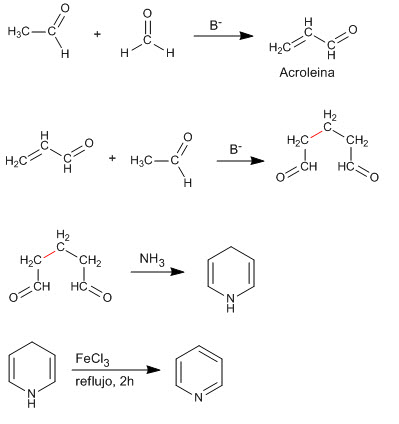
- Dettagli
- Germán Fernández
- TEORIA DELLA PIRIDINA
- Visite: 2471
La sintesi Kröhnke della piridina parte da un piridinio ilide e da un alfa, beta-insaturo per produrre 1,5-dicarbonile, che per reazione con l'ammoniaca dà la piridina finale.
- Dettagli
- Germán Fernández
- TEORIA DELLA PIRIDINA
- Visite: 3604
La sintesi di Guareschi Thorpe prepara 2-piridoni dalla cianoacetammide come componente azotato, insieme a un 1,3-dichetone o 3-chetoestere.