TEORIA CHINOLINA E ISOCHINOLINA
- Dettagli
- Germán Fernández
- TEORIA CHINOLINA E ISOCHINOLINA
- Visite: 2543
a) Basicità
La chinolina e l'isochinolina si comportano come basi attraverso la coppia solitaria di azoto. In mezzi acidi vengono protonati per formare sali di chinolinio e isochinolinio.
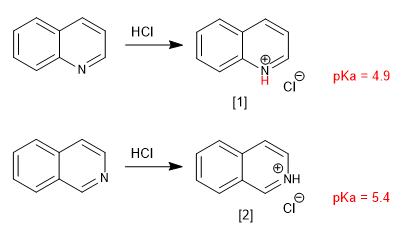
[1] Sale di chinolinio
[2] Sale di isochinolinio
I sostituenti modificano la basicità in modo analogo alla piridina. I gruppi donatori aumentano la basicità e i gruppi attrattori la diminuiscono.
Leggi tutto: Reazioni con coppia solitaria dell'azoto: chinolina e isochinolina
- Dettagli
- Germán Fernández
- TEORIA CHINOLINA E ISOCHINOLINA
- Visite: 3056
La chinolina e l'isochinolina reagiscono con gli elettrofili attraverso l'anello benzenico (carbociclo), a causa della sua maggiore ricchezza elettronica, rispetto all'anello piridinico. Le posizioni più favorite sono 5 e 8.
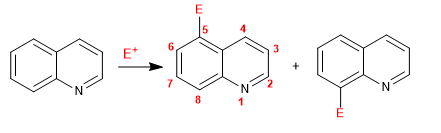
Leggi tutto: Reazione di sostituzione elettrofila in chinolina e isochinolina
- Dettagli
- Germán Fernández
- TEORIA CHINOLINA E ISOCHINOLINA
- Visite: 2473
Gli N-ossidi consentono di posizionare gli elettrofili nella posizione 4 della chinolina.
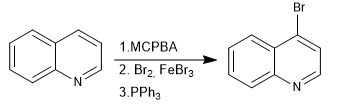
- Dettagli
- Germán Fernández
- TEORIA CHINOLINA E ISOCHINOLINA
- Visite: 2324
La reazione tra derivati alogenati di chinolina e isochinolina con organolitici a bassa temperatura produce lo scambio dell'alogeno con il metallo, generando nuovi organolitici sull'anello.
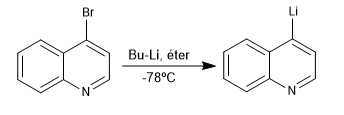
Leggi tutto: Reazione di litiazione in chinolina e isochinolina
- Dettagli
- Germán Fernández
- TEORIA CHINOLINA E ISOCHINOLINA
- Visite: 5848
I nucleofili si aggiungono al carbonio 2 della chinolina, sebbene in determinate condizioni possa anche ricevere attacchi al suo carbonio 4.
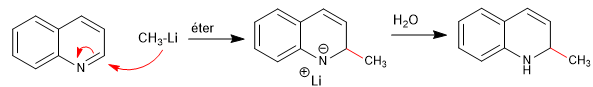
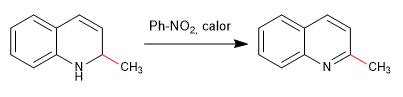
Leggi tutto: Addizione nucleofila a chinoline e isochinoline
- Dettagli
- Germán Fernández
- TEORIA CHINOLINA E ISOCHINOLINA
- Visite: 2358
Le chinoline alogenate in posizione 2,4 subiscono molto facilmente reazioni di sostituzione nucleofila. Da parte sua, l'isochinolina può dare questa reazione solo in posizione 1. Tutti i nucleofili con la capacità di dare S N 2 possono partecipare a questa reazione, i cattivi nucleofili come l'acqua o gli alcoli richiedono un apporto di calore.
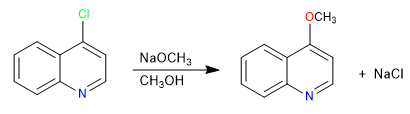
Leggi tutto: Sostituzione nucleofila in chinolina e isochinolina
- Dettagli
- Germán Fernández
- TEORIA CHINOLINA E ISOCHINOLINA
- Visite: 1886
Le piridine con gruppi alchilici in posizione 2,4 hanno idrogeni acidi sul carbonio adiacente all'anello piridinico.
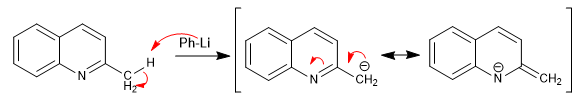
- Dettagli
- Germán Fernández
- TEORIA CHINOLINA E ISOCHINOLINA
- Visite: 31850
Nella sintesi di Skraup, l'anilina reagisce con carbonili a, b-insaturi in un mezzo acido per formare 1,2-diidrochinoline, che vengono trasformate in chinoline per ossidazione. Il carbonile a,b-insaturo può essere ottenuto per disidratazione dell'1,2,3-propanotriolo.
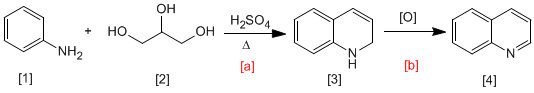
- Dettagli
- Germán Fernández
- TEORIA CHINOLINA E ISOCHINOLINA
- Visite: 8166
Nella sintesi di Conrad-Limpach, i chinoloni si ottengono facendo reagire l'anilina con 3-chetoesteri. In condizioni cinetiche si ottiene il 4-chinolone e in condizioni termodinamiche il 2-chinolone.
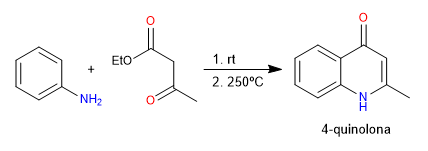
- Dettagli
- Germán Fernández
- TEORIA CHINOLINA E ISOCHINOLINA
- Visite: 2991
Nella sintesi di Combes, le chinoline si ottengono facendo reagire l'anilina con 1,3-dicarbonili, in presenza di catalisi acida. In un primo stadio si forma l'immina, che tautomerizza ad enamin,a, attivando l'anello aromatico cedendo la coppia azotata. Nell'ultimo stadio, la ciclizzazione avviene per attacco del benzene al carbonile della catena
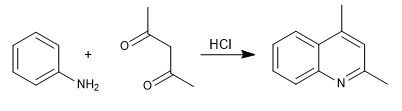
- Dettagli
- Germán Fernández
- TEORIA CHINOLINA E ISOCHINOLINA
- Visite: 3977
La sintesi di Friedländer prepara le chinoline da un nitrobenzene orto-acetilato e un chetone. La sintesi inizia con una condensazione aldolica in un mezzo basico. La riduzione del gruppo nitro ad ammino consente la ciclizzazione mediante formazione di immina.
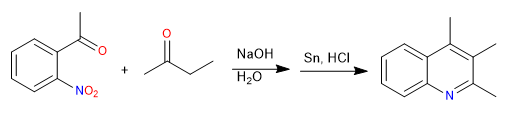
- Dettagli
- Germán Fernández
- TEORIA CHINOLINA E ISOCHINOLINA
- Visite: 3723
La reazione tra 2-amminoetilbenzene e un alcanoil alogenuro in presenza di piridina forma un'ammide. L'ammide viene convertita nell'elettrofilo di Vilsmeier mediante reazione con ossitricloruro di fosforo. La ciclizzazione è prodotta dall'attacco del benzene a detto elettrofilo. Un'ossidazione finale genera isochinolina.
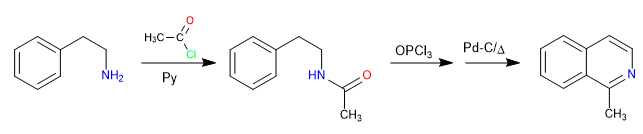
- Dettagli
- Germán Fernández
- TEORIA CHINOLINA E ISOCHINOLINA
- Visite: 3582
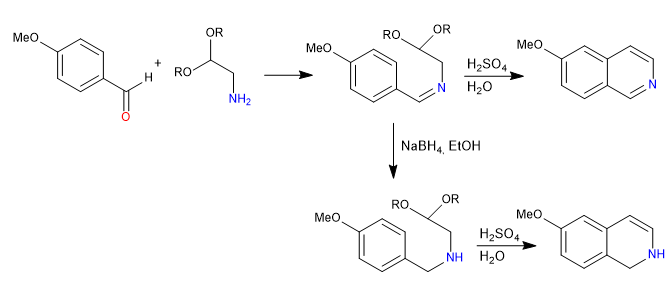
Pictet Spengler è una reazione di tipo Mannich. Nella prima fase, l'elettrofilo di Mannich si forma per reazione dell'ammina con un'aldeide in un mezzo di acido cloridrico. Nella fase finale, la ciclizzazione avviene per attacco del benzene sull'elettrofilo di Mannich. L'isochinolina si ottiene dopo una doppia ossidazione.
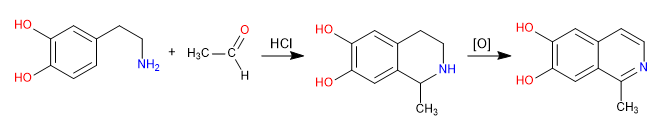
- Dettagli
- Germán Fernández
- TEORIA CHINOLINA E ISOCHINOLINA
- Visite: 2810
La sintesi di Pomeranz-Fritsch prepara le isochinoline facendo reagire benzaldeidi con a-amminoaldeidi protette sotto forma di acetali. In un primo stadio, l'immina si forma per reazione tra la benzaldeide e l'ammina. In una seconda fase, l'acetale viene rotto con acido solforico acquoso, lasciando libera l'aldeide, che ciclizza sotto l'attacco del benzene.