SYNTHESE DES HETEROCYCLES (I)
- Détails
- Germán Fernández
- SYNTHESE DES HETEROCYCLES (I)
- Affichages : 2080

Dans ce sujet, nous étudierons des réactions dans lesquelles des hétérocycles sont générés par des réactions de cyclisation. La formation d'un cycle peut avoir lieu à partir d'une molécule qui contient un centre nucléophile et un autre électrophile, qui s'unissent pour former une liaison. Mais des cycles peuvent aussi être obtenus à partir de deux molécules, dans ce cas il faut deux centres nucléophiles dans l'une et deux centres électrophiles dans l'autre, ou bien chacun contient un centre électrolyle et nucléophile. Lorsque l'on parle de centre nucléophile, on se réfère généralement à un atome possédant des paires isolées et capable d'attaquer un centre de polarité positive (électrophile) pouvant se trouver dans la même molécule ou dans une autre.
- Détails
- Germán Fernández
- SYNTHESE DES HETEROCYCLES (I)
- Affichages : 1533
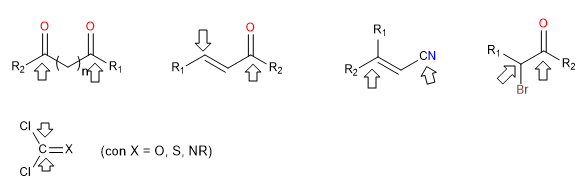
i) Réactifs doublement électrophiles
Ce sont des réactifs qui ont deux positions à forte polarité positive auxquelles les nucléophiles attaquent. Ces réactifs forment des cycles lorsqu'ils sont confrontés à d'autres doublement nucléophiles. Ce sont des dicarbonyles, des carbonyles alpha, bêta-insaturés, alpha-halogénés.
- Détails
- Germán Fernández
- SYNTHESE DES HETEROCYCLES (I)
- Affichages : 2128
Les attaques nucléophiles sont classées en fonction de l'hybridation du centre électrophile (tet (sp 3 ), trig (sp 2 ) et dig (sp). Et dans les fermetures d'anneaux exo et endo, selon que la liaison rompue lors de la fermeture de l'anneau est à l'intérieur (endo) ou à l'extérieur (exo) de l'anneau qui se forme.
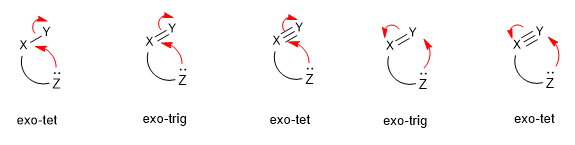
Lire la suite : Classification des attaques nucléophiles (règles de Baldwin)
- Détails
- Germán Fernández
- SYNTHESE DES HETEROCYCLES (I)
- Affichages : 1916
Les réactions intramoléculaires de type S N 2 sont un outil puissant pour former des cycles à 5, 6 et 3 chaînons, entraînant des cyclisations lentes à 4 et 7 chaînons. Ce sont des réactions concertées et stéréospécifiques, ce qui augmente encore leur valeur synthétique.
i) Formation d'aziridine.
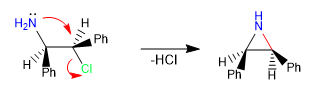
- Détails
- Germán Fernández
- SYNTHESE DES HETEROCYCLES (I)
- Affichages : 2583
Dans cette section nous verrons des exemples de synthèse d'hétérocycles par attaque nucléophile sur des groupements carbonyles. Les carbonyles d'aldéhyde et de cétone donnent lieu à des réactions d'addition nucléophiles, tandis que les carbonyles de dérivés acides (halogénures, anhydrides, esters, amides, nitriles) donnent lieu à des processus d'addition-élimination.
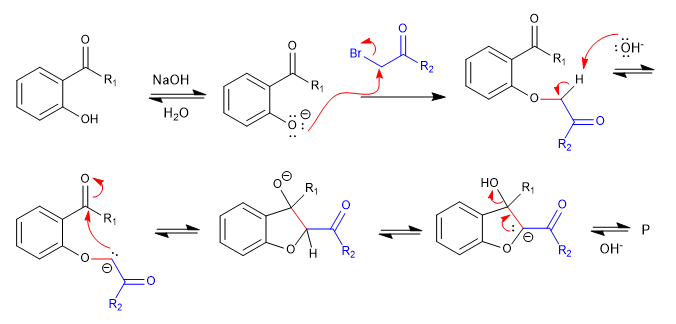
A) On commence par la synthèse d'un benzofurane.
Dans la première étape, nous joignons les réactifs au moyen d'un S N 2 et nous finissons par cyclage avec une réaction d'aldolisation.
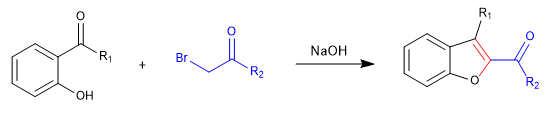
Mécanisme:
- Détails
- Germán Fernández
- SYNTHESE DES HETEROCYCLES (I)
- Affichages : 6656
Les alcynes et les nitriles participent en tant qu'électrophiles à de nombreuses réactions de synthèse d'hétérocycles, étant attaqués par une grande variété de nucléophiles.
A) Le caractère nucléophile-électrophile du propanenitrile et des alpha-aminocétones permet la préparation de pyrroles , voyons un exemple.
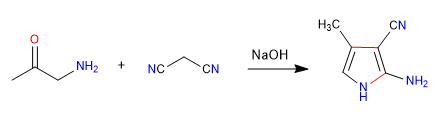
Mécanisme:
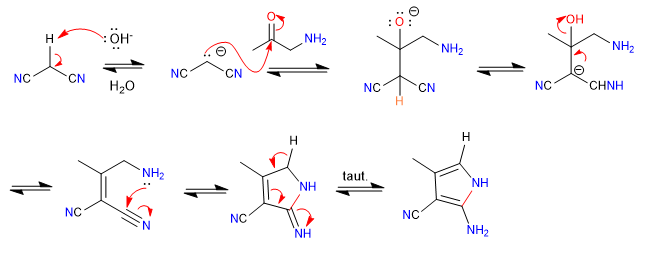
- Détails
- Germán Fernández
- SYNTHESE DES HETEROCYCLES (I)
- Affichages : 1623
Dans cette section, nous verrons des exemples de cyclisations qui ont lieu par des intermédiaires de type radicalaire, carbène ou nitrène.
A) Nous commençons par une cyclisation radicalaire, qui utilise l'hydrure de tributylétain comme réactif et est initiée par l'AIBN
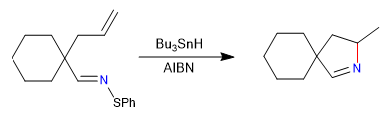
Mécanisme:
1. initiation
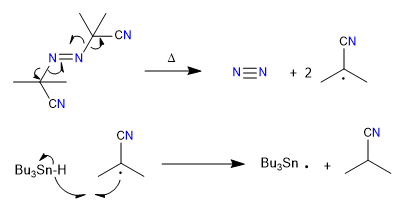
2. Propagation
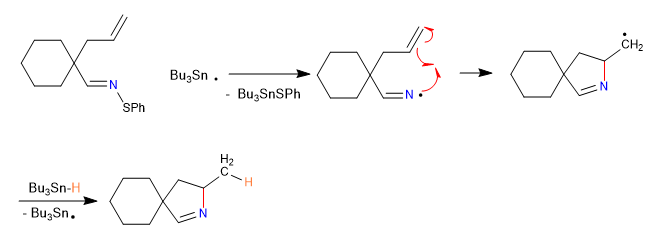
Lire la suite : Cyclisation des carbènes nitrènes et radicaux