REAKSI DALAM KIMIA ORGANIK
REAKSI DALAM KIMIA ORGANIK
Reaksi organik memungkinkan transformasi beberapa zat menjadi zat lain dan pengetahuan mereka sangat penting dalam sintesis senyawa organik. Pada bagian ini reaksi organik terpenting disusun, disusun menurut abjad.
- Detail
- Germán Fernández
- REAKSI DALAM KIMIA ORGANIK
- Dilihat: 12587
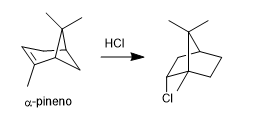
- Detail
- Germán Fernández
- REAKSI DALAM KIMIA ORGANIK
- Dilihat: 13517
Oksidasi Wacker memungkinkan transformasi alkena menjadi keton yang sesuai melalui perlakuan dengan Pd dengan adanya garam tembaga. Tembaga memiliki kemampuan untuk mengoksidasi paladium(0) menjadi paladium(II), yang terakhir menjadi agen katalitik dalam reaksi.
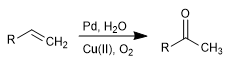
- Detail
- Germán Fernández
- REAKSI DALAM KIMIA ORGANIK
- Dilihat: 14150
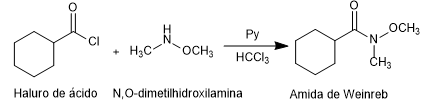
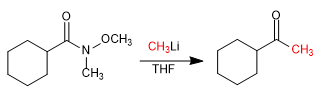
- Detail
- Germán Fernández
- REAKSI DALAM KIMIA ORGANIK
- Dilihat: 8077
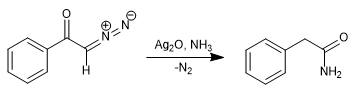
Pada tahun 1902, Wolff mengamati bahwa perlakuan diazoasetofenon (α-diazoketon) dengan Ag 2 O/H 2 O menghasilkan penataan ulang yang menghasilkan asam fenilasetat.
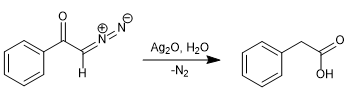
Dengan mengganti air dengan amonia, phenylacetamide diperoleh.
- Detail
- Germán Fernández
- REAKSI DALAM KIMIA ORGANIK
- Dilihat: 15415
- Detail
- Germán Fernández
- REAKSI DALAM KIMIA ORGANIK
- Dilihat: 24057
- Detail
- Germán Fernández
- REAKSI DALAM KIMIA ORGANIK
- Dilihat: 11213
- Detail
- Germán Fernández
- REAKSI DALAM KIMIA ORGANIK
- Dilihat: 8776
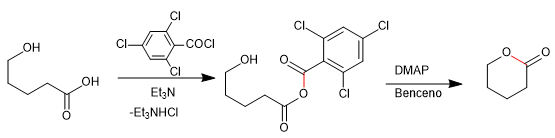
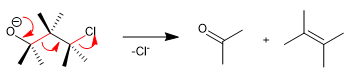
Fragmentasi Wharton adalah reaksi bersama di mana gugus pergi terletak di posisi 4 sehubungan dengan gugus donor elektron. Transfer pasangan bebas dari gugus donor menghasilkan fragmentasi ikatan tetangga dan hilangnya gugus pergi dengan pembentukan ikatan rangkap. Mari kita lihat contohnya:
- Detail
- Germán Fernández
- REAKSI DALAM KIMIA ORGANIK
- Dilihat: 7437
Sintesis Wharton memungkinkan α,β-epoksiketon diubah menjadi alkohol alilik melalui perlakuan dengan hidrazin dalam media asam asetat atau hidrazin hidrat diikuti dengan basa kuat. \alfa,\beta-epoksiketon diperoleh dari \alfa,\beta-tak jenuh keton melalui oksidasi dengan hidrogen peroksida dalam media basa.
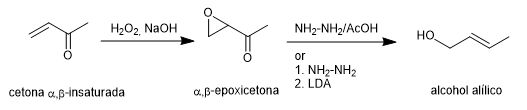
Selengkapnya: Sintesis olefin Wharton (penataan ulang Wharton)
- Detail
- Germán Fernández
- REAKSI DALAM KIMIA ORGANIK
- Dilihat: 11441
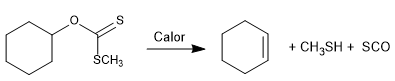
Reaksi Chugaev memungkinkan pembentukan olefin dari xanthans.
- Detail
- Germán Fernández
- REAKSI DALAM KIMIA ORGANIK
- Dilihat: 21691
Aldehida, tanpa hidrogen alfa, memberikan reaksi Cannizzaro pada perlakuan dengan basa kuat (NaOH)
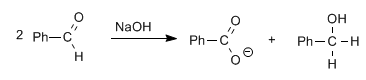
Dalam reaksi ini satu molekul direduksi menjadi alkohol, sementara yang lain dioksidasi menjadi asam karboksilat.
- Detail
- Germán Fernández
- REAKSI DALAM KIMIA ORGANIK
- Dilihat: 10023
Reaksi Blanc memungkinkan klorometilasi senyawa aromatik.
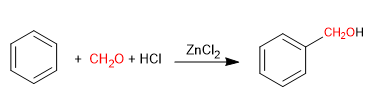
Ia menggunakan sebagai reagen metana dengan gas hidrogen klorida dengan adanya asam Lewis. Hasilnya adalah pengenalan gugus hidroksimetil pada cincin aromatik (benzena) yang hidroksilnya digantikan oleh klorin dengan adanya hidrogen klorida.
- Detail
- Germán Fernández
- REAKSI DALAM KIMIA ORGANIK
- Dilihat: 13352
Reaksi Beckmann menghasilkan penataan ulang oksim menjadi amida. Reaksi ini dilakukan dalam media asam.
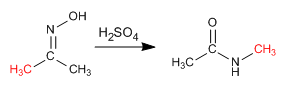
- Detail
- Germán Fernández
- REAKSI DALAM KIMIA ORGANIK
- Dilihat: 14461
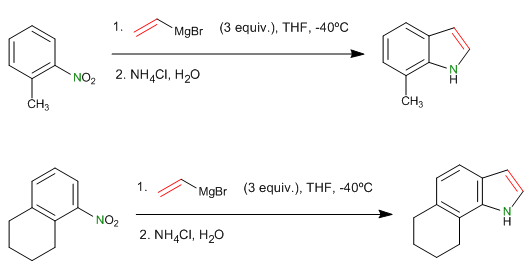
- Detail
- Germán Fernández
- REAKSI DALAM KIMIA ORGANIK
- Dilihat: 9591
Reaksi Barbier memungkinkan untuk mendapatkan reagen organologam yang tidak stabil dalam media reaksi. Awalnya dilakukan dengan logam Magnesium, menghasilkan magnesium in situ. Kemudian diperluas ke logam lain: Sn, Zn..., mampu bekerja di media berair, tanpa memerlukan perlindungan gugus asam (hidroksil).
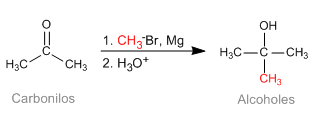
- Detail
- Germán Fernández
- REAKSI DALAM KIMIA ORGANIK
- Dilihat: 10711
Reaksi Schiemann terdiri dari dekomposisi termal diazonium tetrafluoroborat aromatik untuk menghasilkan turunan fluorinasi yang sesuai. Meskipun garam diazonium tidak dapat diuji, diazonium tetrafluoroborat memiliki stabilitas yang signifikan dan dapat dibuat dengan hasil yang baik. Diazonium tetrafluoroborate dibuat dari amina aromatik melalui reaksi diazotisasi.
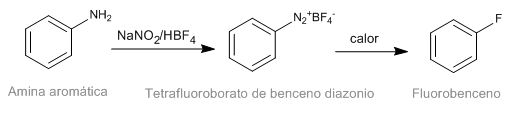
- Detail
- Germán Fernández
- REAKSI DALAM KIMIA ORGANIK
- Dilihat: 8739
Penataan ulang Baker-Venkataraman mengubah orto-asiloksiketon aromatik menjadi beta-diketon dengan perlakuan dasar (katalisis). Beta-diketon sangat menarik dalam sintesis kromon, flavon, dan kumarin. Basa yang paling umum digunakan dalam reaksi adalah: KOH, kalium tert-butoksida, natrium dalam toluena, kalium hidrida.
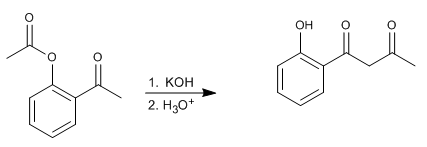
- Detail
- Germán Fernández
- REAKSI DALAM KIMIA ORGANIK
- Dilihat: 10427
1,5-Dienes isomerisasi dengan penataan ulang sigmatropic- [3,3] pada pemanasan. Reaksi yang dikenal sebagai penataan ulang Cope. Penataan ulang 1,5-diena tersubstitusi-N disebut penataan ulang aza-Cope. Bergantung pada posisi yang ditempati oleh nitrogen, kami memiliki: 1-aza-, 2-aza-, 3-aza-Cope. Pengelompokan ulang 3-aza-Cope bertepatan dengan aza-Claisen.
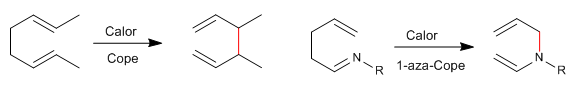
- Detail
- Germán Fernández
- REAKSI DALAM KIMIA ORGANIK
- Dilihat: 10088
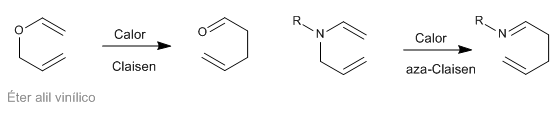
Penataan ulang Sigmatropic [3,3] dari N-allyleneamines dikenal sebagai penataan ulang aza-Claisen. Reaksi ini analog dengan penataan ulang Claisen dari alil vinil eter.
- Detail
- Germán Fernández
- REAKSI DALAM KIMIA ORGANIK
- Dilihat: 8855
Reaksi serupa dengan penataan ulang Wittig, di mana eter logam alfa menyusun ulang alkoksida, menghasilkan alkohol sekunder atau tersier setelah hidrolisis. Dalam kasus aza-[2,3]-Wittig, ini adalah amina tersier berlogam alfa yang menghasilkan amina sekunder setelah hidrolisis.










