RÉACTIONS EN CHIMIE ORGANIQUE
- Détails
- Germán Fernández
- RÉACTIONS EN CHIMIE ORGANIQUE
- Affichages : 13135
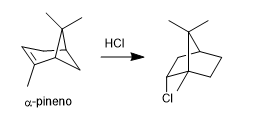
- Détails
- Germán Fernández
- RÉACTIONS EN CHIMIE ORGANIQUE
- Affichages : 14300
L'oxydation Wacker permet la transformation des alcènes en les cétones correspondantes par traitement au Pd en présence de sels de cuivre. Le cuivre a la capacité d'oxyder le palladium(0) en palladium(II), ce dernier étant l'agent catalytique de la réaction.
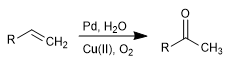
- Détails
- Germán Fernández
- RÉACTIONS EN CHIMIE ORGANIQUE
- Affichages : 15146
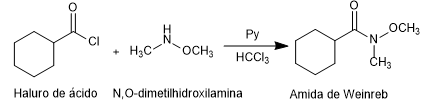
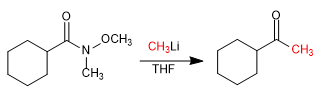
- Détails
- Germán Fernández
- RÉACTIONS EN CHIMIE ORGANIQUE
- Affichages : 8737
En 1902, Wolff a observé que le traitement de la diazoacétophénone (α-diazocétone) avec Ag 2 O/H 2 O produisait un réarrangement qui générait de l'acide phénylacétique.
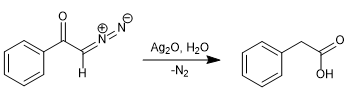
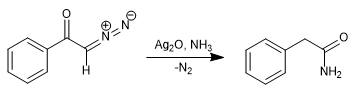
En remplaçant l'eau par de l'ammoniac, on obtient le phénylacétamide.
- Détails
- Germán Fernández
- RÉACTIONS EN CHIMIE ORGANIQUE
- Affichages : 16760
- Détails
- Germán Fernández
- RÉACTIONS EN CHIMIE ORGANIQUE
- Affichages : 24637
- Détails
- Germán Fernández
- RÉACTIONS EN CHIMIE ORGANIQUE
- Affichages : 11809
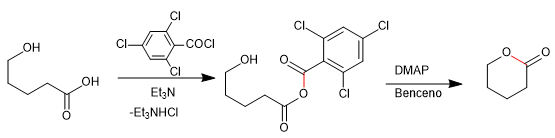
- Détails
- Germán Fernández
- RÉACTIONS EN CHIMIE ORGANIQUE
- Affichages : 8869
La fragmentation de Wharton est une réaction concertée dans laquelle un groupe partant est situé en position 4 par rapport à un groupe donneur d'électrons. Le transfert des paires libres du groupe donneur produit la fragmentation de la liaison voisine et la perte du groupe partant avec formation de doubles liaisons. Voyons un exemple :
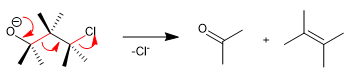
- Détails
- Germán Fernández
- RÉACTIONS EN CHIMIE ORGANIQUE
- Affichages : 7492
La synthèse de Wharton permet de transformer les α,β-époxycétones en alcools allyliques par traitement à l'hydrazine en milieu acide acétique ou à l'hydrate d'hydrazine suivi d'une base forte. La \alpha,\beta-époxycétone est obtenue à partir de la cétone \alpha,\beta-insaturée par oxydation au peroxyde d'hydrogène en milieu basique.
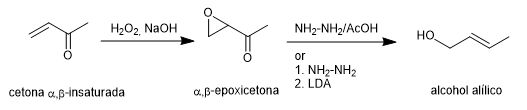
Lire la suite : Synthèse de Wharton des oléfines (réarrangement de Wharton)
- Détails
- Germán Fernández
- RÉACTIONS EN CHIMIE ORGANIQUE
- Affichages : 11845
La réaction de Chugaev permet la formation d'oléfines à partir de xanthanes.
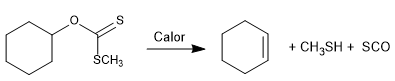
- Détails
- Germán Fernández
- RÉACTIONS EN CHIMIE ORGANIQUE
- Affichages : 26850
Les aldéhydes, sans hydrogènes alpha, donnent la réaction de Cannizzaro lors d'un traitement avec une base forte (NaOH)
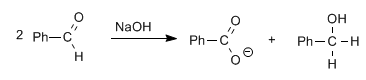
Dans cette réaction, une molécule est réduite en alcool, tandis que l'autre est oxydée en acide carboxylique.
- Détails
- Germán Fernández
- RÉACTIONS EN CHIMIE ORGANIQUE
- Affichages : 11455
La réaction de Blanc permet la chlorométhylation des composés aromatiques.
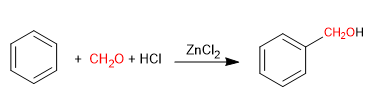
Il utilise comme réactifs le méthane avec du chlorure d'hydrogène gazeux en présence d'un acide de Lewis. Il en résulte l'introduction d'un groupement hydroxyméthyle sur le cycle aromatique (benzène) dont l'hydroxyle est remplacé par du chlore en présence de chlorure d'hydrogène.
- Détails
- Germán Fernández
- RÉACTIONS EN CHIMIE ORGANIQUE
- Affichages : 15779
La réaction de Beckmann produit le réarrangement d'une oxime en un amide. Cette réaction s'effectue en milieu acide.
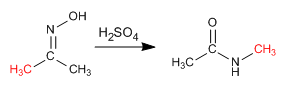
- Détails
- Germán Fernández
- RÉACTIONS EN CHIMIE ORGANIQUE
- Affichages : 15123
- Détails
- Germán Fernández
- RÉACTIONS EN CHIMIE ORGANIQUE
- Affichages : 10103
La réaction de Barbier permet d'obtenir des réactifs organométalliques instables dans le milieu réactionnel. Initialement, il était réalisé avec du magnésium métallique, générant du magnésium in situ. Plus tard elle s'est étendue à d'autres métaux : Sn, Zn..., pouvant travailler en milieu aqueux, sans nécessiter la protection de groupements acides (hydroxyles).
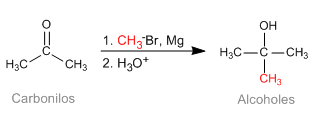
- Détails
- Germán Fernández
- RÉACTIONS EN CHIMIE ORGANIQUE
- Affichages : 11305
La réaction de Schiemann consiste en la décomposition thermique de tétrafluoroborates de diazonium aromatiques pour donner le dérivé fluoré correspondant. Bien que les sels de diazonium soient intestables, les tétrafluoroborates de diazonium ont une stabilité significative et peuvent être préparés avec un bon rendement. Le tétrafluoroborate de diazonium est préparé à partir d'amines aromatiques par la réaction de diazotation.
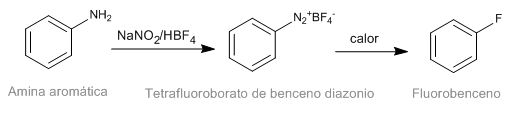
- Détails
- Germán Fernández
- RÉACTIONS EN CHIMIE ORGANIQUE
- Affichages : 9352
Le réarrangement de Baker-Venkataraman transforme les ortho-acyloxycétones aromatiques en bêta-dicétones par traitement basique (catalyse). Les bêta-dicétones présentent un grand intérêt dans la synthèse des chromones, des flavones et des coumarines. Les bases les plus couramment utilisées dans la réaction sont : KOH, tert-butylate de potassium, sodium dans le toluène, hydrure de potassium.
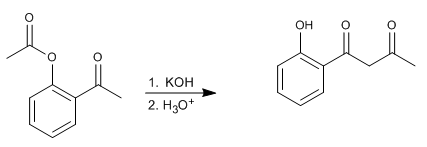
- Détails
- Germán Fernández
- RÉACTIONS EN CHIMIE ORGANIQUE
- Affichages : 10730
Les 1,5-diènes s'isomérisent par des réarrangements sigmatropiques-[3,3] lors du chauffage. Réaction connue sous le nom de réarrangement de Cope. Le réarrangement des 1,5-diènes N-substitués est appelé réarrangement aza-Cope. Selon la position occupée par l'azote, nous avons : 1-aza-, 2-aza-, 3-aza-Cope. Le regroupement 3-aza-Cope coïncide avec l'aza-Claisen.
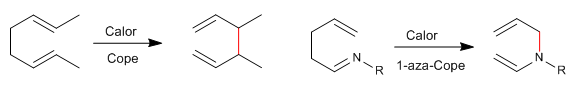
- Détails
- Germán Fernández
- RÉACTIONS EN CHIMIE ORGANIQUE
- Affichages : 10464
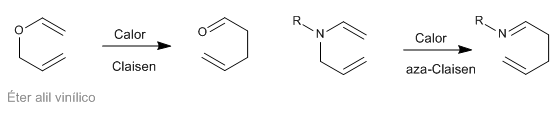
Les réarrangements sigmatropiques [3,3] des N-allylèneamines sont connus sous le nom de réarrangements aza-Claisen. Cette réaction est analogue au réarrangement de Claisen des allyl vinyl éthers.
- Détails
- Germán Fernández
- RÉACTIONS EN CHIMIE ORGANIQUE
- Affichages : 8949
Réaction analogue au réarrangement de Wittig, dans laquelle les éthers métalliques alpha réarrangent les alcoxydes, générant des alcools secondaires ou tertiaires après hydrolyse. Dans le cas de l'aza-[2,3]-Wittig, il s'agit d'amines tertiaires allyliques métallisées en alpha qui produisent des amines secondaires après hydrolyse.








