Existem vários critérios para determinar o grau de aromaticidade de um heterociclo:
A) Comprimentos de ligação.
Um heterociclo é tanto mais aromático quanto menor for a diferença entre os comprimentos das diferentes ligações que compõem o anel. O benzeno tem o mesmo comprimento em todas as suas ligações carbono-carbono, o que o torna o composto mais aromático. Os heterociclos apresentam diferenças nas distâncias de ligação, sendo menos aromáticos quanto maiores forem essas diferenças.
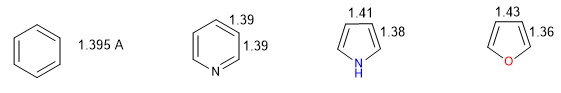
Todas as ligações CC no benzeno medem 1,395 A, uma distância de ligação intermediária entre ligações simples (1,48 A) e duplas (1,34 A). No furano há uma diferença notável entre o comprimento das ligações, indicando uma aromaticidade menor do que no pirrol. A piridina, por outro lado, possui distâncias de ligação CC muito semelhantes entre si e semelhantes às do benzeno, que apresenta maior aromaticidade que o pirrol ou o furano.
B) Dados de ressonância magnética nuclear.
Outra medida do grau de aromaticidade consiste em comparar as constantes de acoplamento dos diferentes hidrogênios. Se as distâncias de ligação entre os carbonos forem as mesmas, as constantes de acoplamento entre os hidrogênios ligados a eles também serão as mesmas. Os sistemas aromáticos apresentam um deslocamento químico entre 7 e 8,5 ppm devido ao fenômeno da anisotropia magnética.
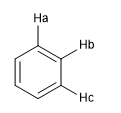
Jab = J bc se as distâncias C a - C b e C b - C c forem iguais, o que mostra um sistema altamente aromático.
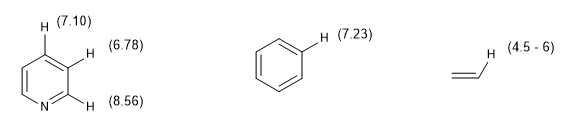
A mudança química dos hidrogênios aromáticos torna fácil distingui-los dos hidrogênios vinílicos.
C) Energias de ressonância.
Os dados de REPE (energia de ressonância por elétron pi) são usados para comparar o grau de aromaticidade de diferentes heterociclos.
O REPE é obtido dividindo-se a energia de ressonância de um sistema pelo número de elétrons pi que ele possui. Podemos definir a energia de ressonância como a diferença de energia entre a molécula com ligações localizadas e deslocalizadas.
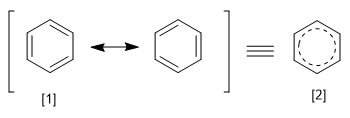
[1] Estrutura canônica
[2] Ressonância Híbrida
| Composto | REPITA |
| Benzeno piridina pirimidina pirrol tiofeno furano | 0,065 0,058 0,049 0,039 0,032 0,007 |
Quanto mais eletronegativo for o heteroátomo, menos aromático o heterociclo apresenta, pois os elétrons pi são atraídos para ele e a conjugação diminui. Este fator explica a maior aromaticidade do pirrol em relação ao furano. Em heterociclos com heteroátomos de eletronegatividade semelhante, mas em que um heteroátomo possui orbitais d, aquele sem orbitais d apresenta maior aromaticidade. Orbitais D, sendo mais difusos, dão sobreposições menos efetivas com átomos de carbono e prejudicam a conjugação. Este fator explica a maior aromaticidade do pirrol em comparação com o tiofeno.