HETEROSIKLUS - AROMATISITAS
- Detail
- Germán Fernández
- HETEROSIKLUS - AROMATISITAS
- Dilihat: 1347
- Detail
- Germán Fernández
- HETEROSIKLUS - AROMATISITAS
- Dilihat: 1381
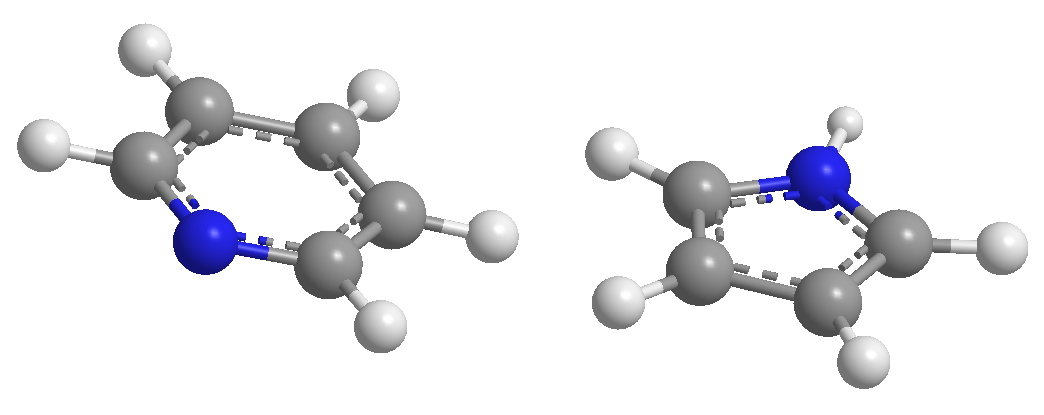
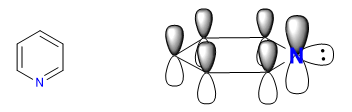
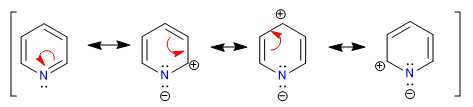
A) Heterocycles dengan 6 atom dan 6 p elektron.
- Detail
- Germán Fernández
- HETEROSIKLUS - AROMATISITAS
- Dilihat: 1174
Ada beberapa kriteria untuk menentukan tingkat aromatisitas suatu heterocycle:
A) Panjang tautan.
Heterocycle semakin aromatik, semakin kecil perbedaan antara panjang ikatan berbeda yang membentuk cincin. Benzena memiliki panjang yang sama di semua ikatan karbon-karbonnya, yang membuatnya menjadi senyawa yang paling aromatik. Heterocycles menyajikan perbedaan jarak ikatan, menjadi kurang aromatik semakin besar perbedaan ini.
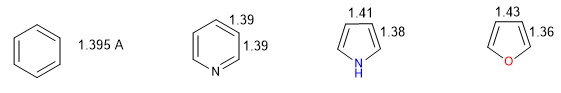
Semua ikatan CC dalam benzena berukuran 1,395 A, jarak ikatan antara antara ikatan tunggal (1,48 A) dan rangkap dua (1,34 A). Dalam furan ada perbedaan mencolok antara panjang ikatan, menunjukkan aromatisitas yang lebih rendah daripada pirol. Piridin, di sisi lain, memiliki jarak ikatan CC yang sangat mirip di antara mereka dan mirip dengan benzena, yang menunjukkan aromatisitas lebih besar daripada pirol atau furan.
Selengkapnya: Kriteria untuk menentukan aromatisitas dalam heterocycles
- Detail
- Germán Fernández
- HETEROSIKLUS - AROMATISITAS
- Dilihat: 1206
Heteroaromatik beranggota 6 yang memiliki gugus -OH atau -SH dalam posisi 2,4 lebih disukai ada dalam larutan dalam bentuk keto atau thioketo. Dalam larutan, senyawa dengan gugus amino dalam posisi 2,4 lebih disukai ada dalam bentuk amino, daripada sebagai tautomer imino.
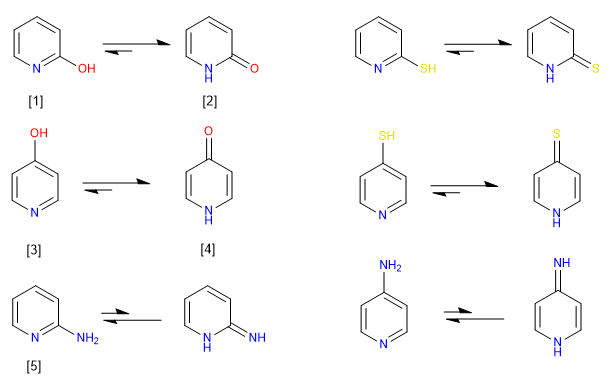
[1] 2-Hidroksipiridin
[2] 2-Piridon
[3] 4-Hidroksipiridin
[4] 4-Piridon
[5] 2-Aminopyridine
- Detail
- Germán Fernández
- HETEROSIKLUS - AROMATISITAS
- Dilihat: 1155
Pada bagian ini kita akan mempelajari pengaruh tegangan annular pada sifat-sifat heterocycles.
A) Tegangan sudut dalam heterocycles kecil (3 dan 4 anggota).
Sudut ikatan alami dari karbon sp 3 adalah 109,5o, namun dalam siklus beranggota tiga sudut ini berkurang menjadi 60o, yang menghasilkan tegangan yang sangat besar. Untuk meredakan ketegangan ini, ikatan antar karbon yang tidak lagi lurus, membengkok, menimbulkan ikatan melengkung yang disebut “banana bond”. Sudut yang dibentuk oleh ikatan ini adalah 104o, perbedaan yang lebih dapat ditoleransi.
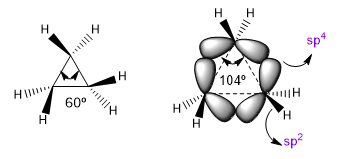
| Hibridisasi | sudut ikatan |
| sp sp 2 sp 3 sp 4 | 180º 120º 109,5º 104 |
- Detail
- Germán Fernández
- HETEROSIKLUS - AROMATISITAS
- Dilihat: 1328
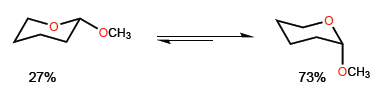
Fenomena di mana konformasi aksial dari heterosiklik tersubstitusi pada posisi 2 distabilkan disebut efek anomerik.Misalnya, 2-metoksioksan menyajikan rasio 27:73 yang mendukung konformasi dengan metoksida pada posisi aksial.