Nesta seção vamos estudar a influência das tensões anulares nas propriedades dos heterociclos.
A) Tensão angular em pequenos heterociclos (3 e 4 barras).
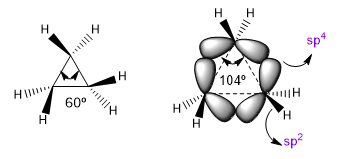
Os ângulos naturais de ligação de um carbono sp 3 são 109,5o, porém em ciclos de três membros esse ângulo diminui para 60o, o que produz uma enorme tensão. Para aliviar essa tensão, as ligações entre os carbonos deixam de ser retas, dobrando-se, dando origem a ligações curvas chamadas de “ligações banana”. Os ângulos formados por essas ligações são de 104º, uma discrepância mais tolerável.
| Hibridação | ângulo de ligação |
| sp sp 2 sp 3 sp 4 | 180º 120º 109,5º 104º |
Esta situação faz com que as ligações CC tendam a uma hibridização teórica sp 4 enquanto as ligações CH têm sp 2 . Essas hibridações nos permitirão explicar as variações nas propriedades espectroscópicas e de basicidade. Nos espectros de infravermelho observa-se que à medida que o caráter p de uma ligação diminui, a absorção se move em direção a um maior número de ondas. Vamos comparar amidas não cíclicas com lactamas estressadas para ver esse efeito.
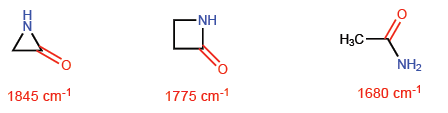
Na azetidin-2-ona, o caractere p da ligação C=O é menor do que nas outras moléculas e, portanto, a absorção da radiação infravermelha se move em direção a um maior número de ondas.
Outra propriedade que é influenciada pela tensão desses heterociclos é a basicidade. Um aumento no caráter p do par solitário produz uma diminuição na basicidade. Assim, entre uma amina cíclica e uma acíclica, a cíclica é menos básica.
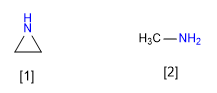
[1] Aziridina
[2] Metilamina
A aziridina é menos básica que a metilamina. A hibridização de pares solitários da aziridina se aproxima de sp2, enquanto a da metilamina é sp3 . O menor caráter p da aziridina a torna menos básica.
B) Tensão anular em grandes anéis. A ciclooctina é conhecida por ser o menor alcino cíclico existente. Os cicloalcinos menores produzem uma distorção no ângulo de ligação correspondente à hibridação sp, gerando uma tensão na molécula que a inviabiliza.
Entretanto, há uma exceção a essa regra observada nas tiacicloheptinas, que se explica pelo maior comprimento da ligação CS em relação à CC.
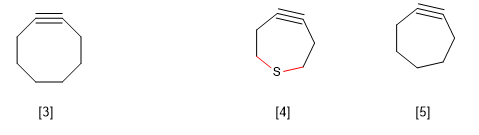
[3] Ciclooctina
[4] O maior comprimento das ligações CS em comparação com o CC permite a existência deste alcino cíclico.
[5] Não existe
C) Rigidez das bicicletas.
A rigidez dos bicilos, a impossibilidade de girar, impede algumas ressonâncias, dando origem a propriedades anômalas na molécula. As amidas deslocalizam os pares isolados do nitrogênio para o oxigênio da carbonila, o que remove a basicidade do nitrogênio. Porém, quando a amida faz parte de um sistema bicíclico, essa atribuição não é viável e o nitrogênio apresenta-se fortemente básico.
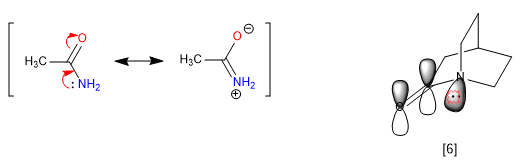
[6] O par de nitrogênio não pode ser transferido, porque seu orbital não é paralelo ao da carbonila.
O nitrogênio 1-azabiciclo[2.2.2]octano apresenta uma basicidade notável comparável às aminas aromáticas, com um pKa para seu ácido conjugado de 5,3. Os dados espectroscópicos para esta amida também são únicos. Assim, a carbonila absorve a 1762 cm -1 , mais típica de uma cetona estressada do que de uma amida. A explicação está mais uma vez na impossibilidade de transferir o par de nitrogênio livre.
D) Equilíbrio conformacional em anéis de seis membros .
O menor comprimento de ligação CO em comparação com CC introduz certas peculiaridades no equilíbrio conformacional de heterociclos de seis membros com oxigênio.
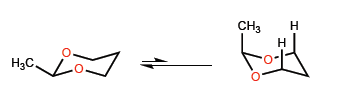
As distâncias curtas do CO fazem com que o metil se aproxime dos hidrogênios da posição 3, dando origem a interações 1,3-diaxiais que deslocam o equilíbrio conformacional totalmente para a esquerda.
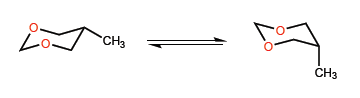
Neste segundo exemplo, a situação muda, uma vez que a interação entre os pares solitários de metil e oxigênio não é muito importante, e um grupo terc-butila pode até estar localizado em uma posição axial.