THÉORIE DE LA PYRIDINE
- Détails
- Germán Fernández
- THÉORIE DE LA PYRIDINE
- Affichages : 14848
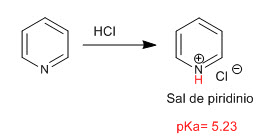
La pyridine se comporte comme une base à travers la paire isolée de l'atome d'azote. En présence d'acides, il est protoné, générant des sels de pyridinium.
- Détails
- Germán Fernández
- THÉORIE DE LA PYRIDINE
- Affichages : 12685
a) Réaction d'alkylation
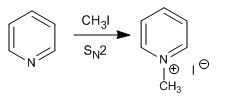
La pyridine réagit avec les halogénures d'alkyle, les halogénures d'alcanoyle et les anhydrides pour former des sels de pyridinium. La réaction se déroule par l'attaque nucléophile du seul couple d'azote sur le carbone électrophile desdits réactifs.
- Détails
- Germán Fernández
- THÉORIE DE LA PYRIDINE
- Affichages : 11183
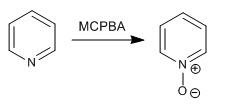
La pyridine est oxydée en présence de peroxyde d'hydrogène ou de peracides pour former des N-oxydes de pyridine.
- Détails
- Germán Fernández
- THÉORIE DE LA PYRIDINE
- Affichages : 18273
Le cycle pyridine est capable d'attaquer les électrophiles, de manière analogue au benzène, donnant la réaction de substitution électrophile aromatique. En raison de l'électronégativité de l'azote, la pyridine est beaucoup moins réactive que le benzène dans SE, nécessitant des conditions de réaction plus drastiques.
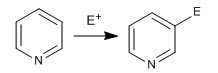
- Détails
- Germán Fernández
- THÉORIE DE LA PYRIDINE
- Affichages : 2390
Il est possible de placer des électrophiles en position 4 de la pyridine par la formation de N-oxydes.
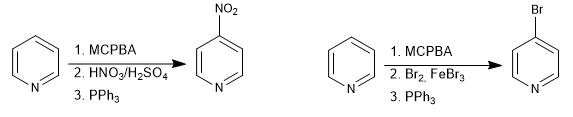
Lire la suite : Substitution électrophile en position 4 de la pyridine
- Détails
- Germán Fernández
- THÉORIE DE LA PYRIDINE
- Affichages : 1948
Cette réaction forme des organolithiens à partir d'une pyridine halogénée. Les organolithiques permettent l'attaque d'électrophiles carbonés très variés, tels que : les halogénures d'alkyles primaires, les aldéhydes, les cétones, les nitriles, les esters, les époxydes...
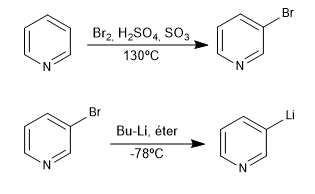
- Détails
- Germán Fernández
- THÉORIE DE LA PYRIDINE
- Affichages : 2405
Les nucléophiles durs (organométalliques, amides, hydrures de lithium et d'aluminium) attaquent la position 2 du cycle pyridine, donnant lieu à des réactions d'addition nucléophiles. Dans le cas où une dernière étape d'oxydation se produit, avec perte d'hydrure, on peut parler de substitution nucléophile.
a) Ajout d'organométalliques
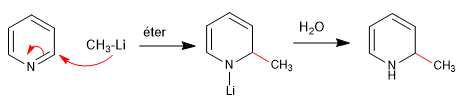
La réaromatisation du cycle est possible en ajoutant un oxydant qui élimine "H 2 "
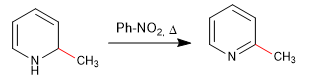
b) Ajout d'amide. La réaction de Chichibabin
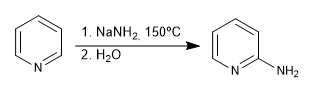
Lire la suite : Réactions d'addition nucléophiles aux pyridines
- Détails
- Germán Fernández
- THÉORIE DE LA PYRIDINE
- Affichages : 2926
Les pyridines avec des groupes partants aux positions 2,4 réagissent avec les nucléophiles, entraînant la substitution du groupe partant au nucléophile. La réaction suit un mécanisme d'addition-élimination.
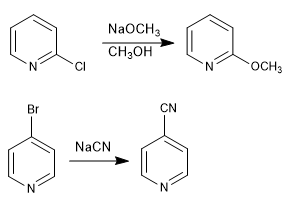
Lire la suite : Réactions de substitution nucléophile dans la pyridine
- Détails
- Germán Fernández
- THÉORIE DE LA PYRIDINE
- Affichages : 1804
Les pyridines avec des groupes partants en position 3 ne donnent pas de substitutions nucléophiles, mais peuvent subir une élimination en présence de bases fortes, conduisant à un intermédiaire appelé pyridine (équivalent du benzyne), qui est attaqué par le nucléophile du milieu.
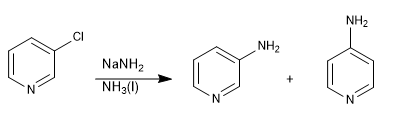
Lire la suite : Substitution nucléophile par élimination-addition : la pyridine
- Détails
- Germán Fernández
- THÉORIE DE LA PYRIDINE
- Affichages : 1672
Les pyridines avec des groupes 2,4-alkyle ont des hydrogènes acides dans la position voisine du cycle. Ces hydrogènes peuvent être éliminés en utilisant des bases fortes telles que le tert-butyllithium, le LDA, etc.
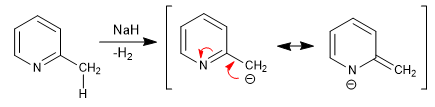
La base obtenue a un caractère nucléophile important, ce qui permet d'allonger la chaîne en attaquant différents électrophiles.
- Détails
- Germán Fernández
- THÉORIE DE LA PYRIDINE
- Affichages : 18818
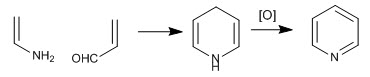
 La molécule de pyridine peut être obtenue en faisant réagir des énamines avec des a,b-insaturés. Ainsi, la réaction entre l'éthénamine et le propénal, suivie d'une oxydation, produit de la pyridine.
La molécule de pyridine peut être obtenue en faisant réagir des énamines avec des a,b-insaturés. Ainsi, la réaction entre l'éthénamine et le propénal, suivie d'une oxydation, produit de la pyridine.
- Détails
- Germán Fernández
- THÉORIE DE LA PYRIDINE
- Affichages : 9254
La condensation de deux molécules d'éthanal et d'une de méthane produit un composé 1,5-dicarbonyle qui réagit avec l'ammoniac pour générer de la pyridine.
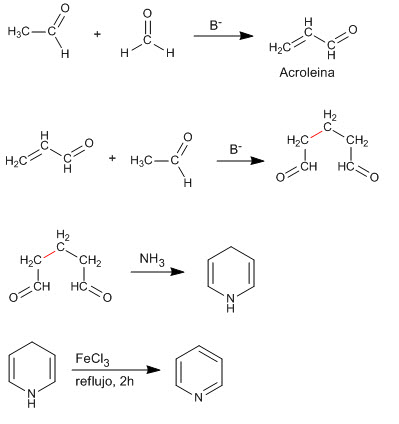
- Détails
- Germán Fernández
- THÉORIE DE LA PYRIDINE
- Affichages : 1762
La synthèse de Kröhnke de la pyridine part d'un ylure de pyridinium et d'un alpha, bêta-insaturé pour donner le 1,5-dicarbonyle, qui par réaction avec l'ammoniac donne la pyridine finale.
- Détails
- Germán Fernández
- THÉORIE DE LA PYRIDINE
- Affichages : 2349
La synthèse de Guareschi Thorpe prépare des 2-pyridones à partir de cyanoacétamide comme composant azoté, avec une 1,3-dicétone ou un 3-cétoester.