PYRIDIN-THEORIE
- Details
- Germán Fernández
- PYRIDIN-THEORIE
- Zugriffe: 15231
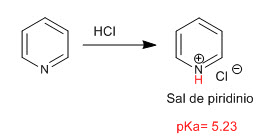
Pyridin verhält sich durch das freie Elektronenpaar des Stickstoffatoms wie eine Base. In Gegenwart von Säuren wird es protoniert, wobei Pyridiniumsalze entstehen.
- Details
- Germán Fernández
- PYRIDIN-THEORIE
- Zugriffe: 13104
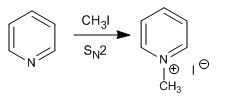
a) Alkylierungsreaktion
Pyridin reagiert mit Alkylhalogeniden, Alkanoylhalogeniden und Anhydriden unter Bildung von Pyridiniumsalzen. Die Reaktion verläuft durch den nukleophilen Angriff des einsamen Stickstoffpaares auf den elektrophilen Kohlenstoff der Reagenzien.
- Details
- Germán Fernández
- PYRIDIN-THEORIE
- Zugriffe: 11089
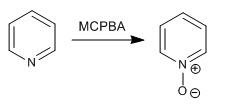
Pyridin wird in Gegenwart von Wasserstoffperoxid oder Persäuren oxidiert, um Pyridin-N-oxide zu bilden.
- Details
- Germán Fernández
- PYRIDIN-THEORIE
- Zugriffe: 18805
Der Pyridinring ist in der Lage, Elektrophile analog zu Benzol anzugreifen, was die aromatische elektrophile Substitutionsreaktion ergibt. Aufgrund der Elektronegativität von Stickstoff ist Pyridin in SE viel weniger reaktiv als Benzol, was drastischere Reaktionsbedingungen erfordert.
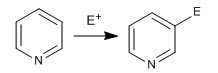
- Details
- Germán Fernández
- PYRIDIN-THEORIE
- Zugriffe: 2343
Durch die Bildung von N-Oxiden ist es möglich, Elektrophile in Position 4 des Pyridins zu platzieren.
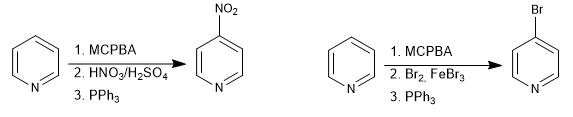
Weiterlesen: Elektrophile Substitution an Position 4 von Pyridin
- Details
- Germán Fernández
- PYRIDIN-THEORIE
- Zugriffe: 2126
Diese Reaktion bildet aus einem halogenierten Pyridin Organolithium. Organolithics ermöglichen den Angriff sehr unterschiedlicher Kohlenstoff-Elektrophile, wie z. B.: primäre Alkylhalogenide, Aldehyde, Ketone, Nitrile, Ester, Epoxide...
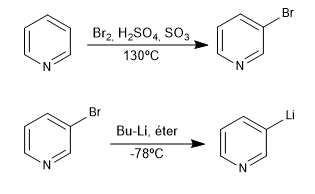
- Details
- Germán Fernández
- PYRIDIN-THEORIE
- Zugriffe: 2476
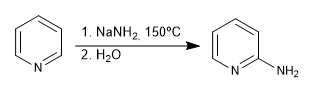
Harte Nucleophile (organometallisch, Amid, Lithiumaluminiumhydrid) greifen die Position 2 des Pyridinrings an und führen zu nucleophilen Additionsreaktionen. Tritt eine letzte Oxidationsstufe mit Hydridverlust ein, spricht man von nukleophiler Substitution.
a) Zugabe von Organometallen
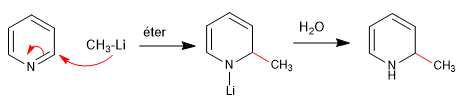
Die Rearomatisierung des Rings ist möglich durch Zugabe eines Oxidationsmittels, das "H 2 " entfernt.
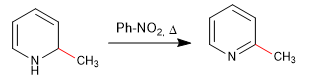
b) Addition von Amid. Chichibabins Reaktion
- Details
- Germán Fernández
- PYRIDIN-THEORIE
- Zugriffe: 3041
Pyridine mit Abgangsgruppen an den Positionen 2,4 reagieren mit Nukleophilen, was zur Substitution der Abgangsgruppe für das Nukleophil führt. Die Reaktion folgt einem Additions-Eliminierungs-Mechanismus.
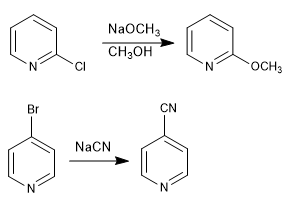
- Details
- Germán Fernández
- PYRIDIN-THEORIE
- Zugriffe: 2257
Pyridine mit Abgangsgruppen in Position 3 ergeben keine nukleophilen Substitutionen, können aber in Gegenwart starker Basen eliminiert werden, was zu einem Zwischenprodukt namens Pyridin (äquivalent zu Benzin) führt, das vom Nukleophil in der Mitte angegriffen wird.
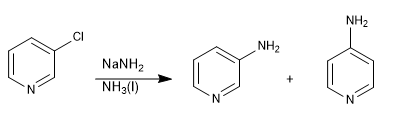
Weiterlesen: Nucleophile Substitution durch Eliminierungsaddition: das Pyridin
- Details
- Germán Fernández
- PYRIDIN-THEORIE
- Zugriffe: 1737
Pyridine mit 2,4-Alkylgruppen haben acide Wasserstoffatome in der Nachbarposition des Rings. Diese Wasserstoffatome können mit starken Basen wie tert-Butyllithium, LDA usw. entfernt werden.
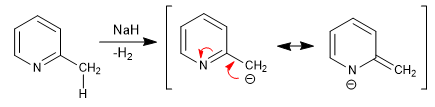
Die erhaltene Base hat einen wichtigen nukleophilen Charakter, der es ermöglicht, die Kette durch Angriff verschiedener Elektrophile zu verlängern.
- Details
- Germán Fernández
- PYRIDIN-THEORIE
- Zugriffe: 17169
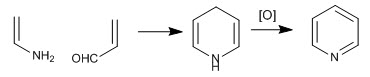
 Das Pyridinmolekül kann durch Umsetzung von Enaminen mit a,b-ungesättigten erhalten werden. Somit erzeugt die Reaktion zwischen Ethenamin und Propenal, gefolgt von Oxidation, Pyridin.
Das Pyridinmolekül kann durch Umsetzung von Enaminen mit a,b-ungesättigten erhalten werden. Somit erzeugt die Reaktion zwischen Ethenamin und Propenal, gefolgt von Oxidation, Pyridin.
- Details
- Germán Fernández
- PYRIDIN-THEORIE
- Zugriffe: 9589
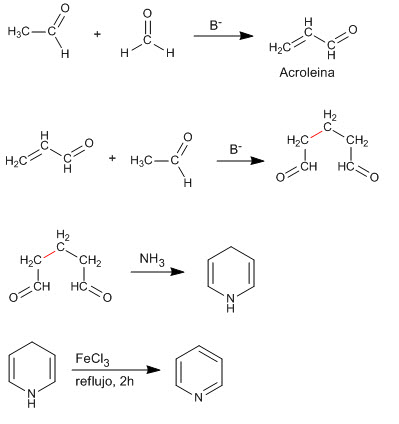
Die Kondensation von zwei Molekülen Ethanal und einem Methan erzeugt eine 1,5-Dicarbonylverbindung, die mit Ammoniak reagiert, um Pyridin zu erzeugen.
- Details
- Germán Fernández
- PYRIDIN-THEORIE
- Zugriffe: 1787
Die Kröhnke-Synthese von Pyridin beginnt mit einem Pyridiniumylid und einem alpha, beta-ungesättigten 1,5-Dicarbonyl, das durch Reaktion mit Ammoniak das endgültige Pyridin ergibt.
- Details
- Germán Fernández
- PYRIDIN-THEORIE
- Zugriffe: 1929
Die Synthese von Guareschi Thorpe stellt 2-Pyridone aus Cyanoacetamid als stickstoffhaltiger Komponente zusammen mit einem 1,3-Diketon oder 3-Ketoester her.