Esistono diversi criteri per determinare il grado di aromaticità di un eterociclo:
A) Lunghezze dei collegamenti.
Un eterociclo è tanto più aromatico quanto minore è la differenza tra le lunghezze dei diversi legami che compongono l'anello. Il benzene ha la stessa lunghezza in tutti i suoi legami carbonio-carbonio, il che lo rende il composto più aromatico. Gli eterocicli presentano differenze nelle distanze di legame, essendo meno aromatici quanto maggiori sono queste differenze.
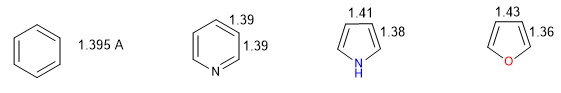
Tutti i legami CC nel benzene misurano 1,395 A, una distanza di legame intermedia tra legami singoli (1,48 A) e doppi (1,34 A). Nel furano c'è una notevole differenza nella lunghezza dei legami, indice di un'aromaticità inferiore rispetto al pirrolo. La piridina, invece, ha tra loro distanze di legame CC molto simili e simili a quelle del benzene, che mostra una maggiore aromaticità rispetto al pirrolo o al furano.
B) Dati di risonanza magnetica nucleare.
Un'altra misura del grado di aromaticità consiste nel confrontare le costanti di accoppiamento dei diversi idrogeni. Se le distanze di legame tra gli atomi di carbonio sono le stesse, anche le costanti di accoppiamento tra gli idrogeni ad esse attaccati sono le stesse. I sistemi aromatici presentano uno spostamento chimico tra 7 e 8,5 ppm dovuto al fenomeno dell'anisotropia magnetica.
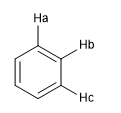
J ab = J bc se le distanze C a - C b e C b - C c sono uguali, il che mostra un sistema altamente aromatico.
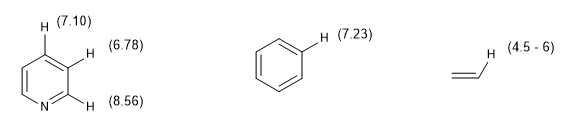
Lo spostamento chimico degli idrogeni aromatici rende facile distinguerli dagli idrogeni vinilici.
C) Energie di risonanza.
I dati REPE (energia di risonanza per elettrone pi) vengono utilizzati per confrontare il grado di aromaticità di diversi eterocicli.
Il REPE si ottiene dividendo l'energia di risonanza di un sistema per il numero di elettroni pi che possiede. Possiamo definire l'energia di risonanza come la differenza di energia tra la molecola con legami localizzati e delocalizzati.
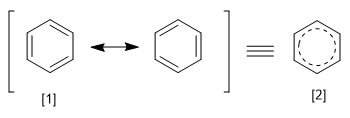
[1] Struttura canonica
[2] Ibrido di risonanza
| Composto | REPE |
| Benzene piridina pirimidina pirrolo tiofene furano |
0,065 0,058 0,049 0,039 0,032 0,007 |
Più elettronegativo è l'eteroatomo, meno aromatico presenta l'eterociclo, poiché gli elettroni pi sono attratti da esso e la coniugazione diminuisce. Questo fattore spiega la maggiore aromaticità del pirrolo rispetto al furano. Negli eterocicli con eteroatomi di elettronegatività simile, ma in cui un eteroatomo ha orbitali d, quello senza orbitali d presenta maggiore aromaticità. Gli orbitali D, essendo più diffusi, danno sovrapposizioni meno efficaci con gli atomi di carbonio e compromettono la coniugazione. Questo fattore spiega la maggiore aromaticità del pirrolo rispetto al tiofene.