In questa sezione studieremo l'influenza delle sollecitazioni anulari sulle proprietà degli eterocicli.
A) Sforzo angolare in piccoli eterocicli (3 e 4 membri).
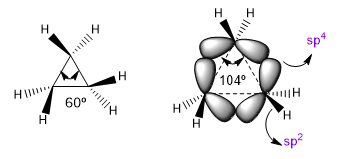
Gli angoli di legame naturali di un carbonio sp3 sono 109,5º, tuttavia nei cicli a tre membri questo angolo diminuisce a 60º, il che produce un'enorme tensione. Per alleviare questa tensione, i legami tra i carboni non sono più diritti, piegandosi, dando origine a legami curvi chiamati "legami a banana". Gli angoli formati da questi legami sono di 104°, una discrepanza più tollerabile.
| Ibridazione | Angolo di legame |
| sp sp2 sp3 sp4 |
180º 120º 109,5º 104º |
Questa situazione fa sì che i legami CC tendano ad una teorica ibridazione sp4 mentre i legami CH hanno sp2 . Queste ibridazioni ci permetteranno di spiegare le variazioni nelle proprietà spettroscopiche e di basicità. Negli spettri infrarossi si osserva che al diminuire del carattere p di un legame, l'assorbimento si sposta verso un numero maggiore di onde. Confrontiamo le ammidi non cicliche con i lattamici stressati per vedere questo effetto.
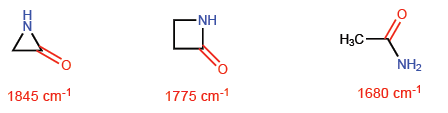
Nell'azetidin-2-one il carattere p del legame C=O è minore che nelle altre molecole e quindi l'assorbimento della radiazione infrarossa si sposta verso un numero maggiore di onde.
Un'altra proprietà influenzata dal ceppo di questi eterocicli è la basicità. Un aumento del carattere p della coppia solitaria produce una diminuzione della basicità. Pertanto, tra un'ammina ciclica e un'ammina aciclica, il ciclico è meno basico.
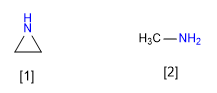
[1] Aziridina
[2] Metilammina
L'aziridina è meno basica della metilammina. L'ibridazione a coppia solitaria dell'aziridina si avvicina a sp2 mentre quella della metilammina è sp3 . Il carattere p più piccolo dell'aziridina lo rende meno basico.
B) Sforzo anulare nei grandi anelli. La ciclooctina è nota per essere il più piccolo alchino ciclico esistente. I cicloalchini più piccoli producono una distorsione nell'angolo di legame corrispondente all'ibridazione sp, generando una tensione nella molecola che la rende irrealizzabile.
Tuttavia, c'è un'eccezione a questa regola osservata nelle tiacicloeptine, che è spiegata dalla maggiore lunghezza del legame CS rispetto al CC.
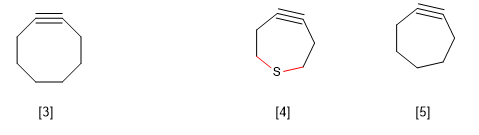
[3] cicloottino
[4] La maggiore lunghezza dei legami CS rispetto ai CC consente l'esistenza di questo alchino ciclico.
[5] Non esiste
C) Rigidità delle biciclette.
La rigidità dei bicilli, l'impossibilità di girare, impedisce alcune risonanze, dando origine a proprietà anomale nella molecola. Le ammidi delocalizzano le coppie solitarie dall'azoto all'ossigeno carbonilico, che rimuove la basicità dell'azoto. Tuttavia, quando l'ammide fa parte di un sistema biciclico, questa assegnazione non è praticabile e l'azoto appare fortemente basico.
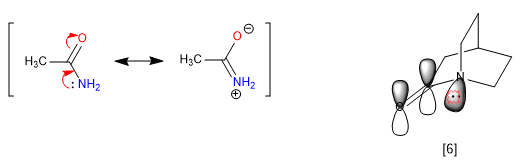
[6] La coppia di azoto non può essere trasferita, perché il suo orbitale non è parallelo a quello del carbonile.
L'azoto 1-azabiciclo[2.2.2]ottano presenta una notevole basicità paragonabile alle ammine aromatiche, con un pKa per il suo acido coniugato di 5,3. Anche i dati spettroscopici per questa ammide sono unici. Così il carbonile assorbe a 1762 cm-1 , più tipico di un chetone stressato che di un'ammide. La spiegazione sta ancora una volta nell'impossibilità di trasferire la coppia libera di azoto.
D) Equilibrio conformazionale in anelli a membri sis .
La minore lunghezza del legame CO rispetto a CC introduce alcune peculiarità negli equilibri conformazionali degli eterocicli a sei membri con l'ossigeno.
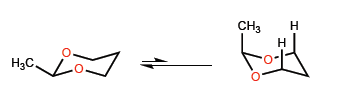
Le brevi distanze CO fanno sì che il metile si avvicini agli idrogeni in posizione 3, dando origine a interazioni 1,3-diassiali che spostano l'equilibrio conformazionale completamente a sinistra.
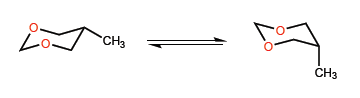
In questo secondo esempio la situazione cambia, in quanto l'interazione tra le coppie solitarie metile e ossigeno non è molto importante, e un gruppo tert-butile può trovarsi anche in posizione assiale.