THÉORIE QUINOLINE ET ISOQUINOLINE
- Détails
- Germán Fernández
- THÉORIE QUINOLINE ET ISOQUINOLINE
- Affichages : 2088
a) Basicité
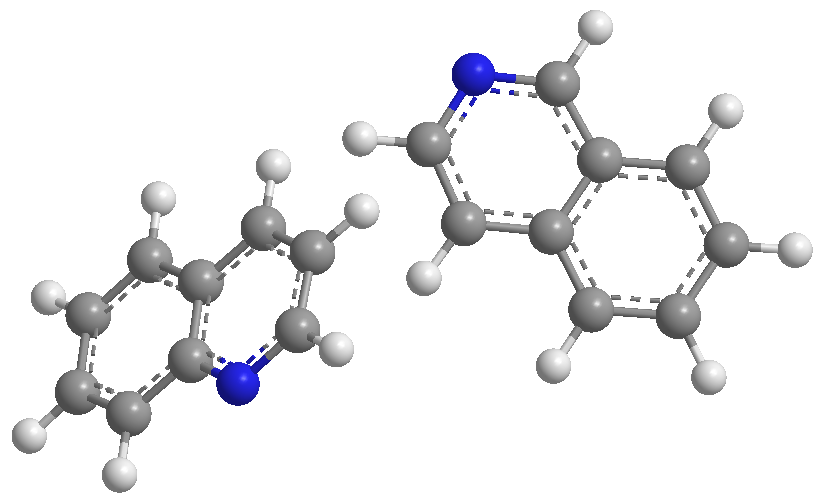
La quinoléine et l'isoquinoléine se comportent comme des bases à travers la seule paire d'azote. En milieu acide, ils sont protonés pour former des sels de quinolinium et d'isoquinolinium.
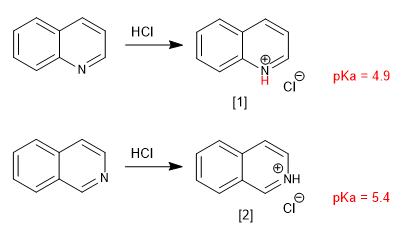
[1] Sel de quinolinium
[2] Sel d'isoquiniolinium
Les substituants modifient la basicité d'une manière analogue à la pyridine. Les groupes donneurs augmentent la basicité et les groupes attracteurs la diminuent.
Lire la suite : Réactions avec le couple isolé d'azote : quinoléine et isoquinoléine
- Détails
- Germán Fernández
- THÉORIE QUINOLINE ET ISOQUINOLINE
- Affichages : 2651
La quinoléine et l'isoquinoléine réagissent avec les électrophiles via le cycle benzénique ( carbocycle ), en raison de sa plus grande richesse électronique, par rapport au cycle pyridine. Les positions les plus favorisées sont 5 et 8.
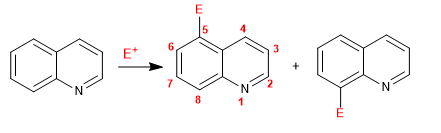
Lire la suite : Réaction de substitution électrophile dans la quinoléine et l'isoquinoléine
- Détails
- Germán Fernández
- THÉORIE QUINOLINE ET ISOQUINOLINE
- Affichages : 2155
Les N-oxydes permettent de placer les électrophiles en position 4 de la quinoléine.
- Détails
- Germán Fernández
- THÉORIE QUINOLINE ET ISOQUINOLINE
- Affichages : 1992
La réaction entre les dérivés halogénés de la quinoléine et de l'isoquinoléine avec les organolithiques à basse température produit l'échange d'halogène contre le métal, générant de nouveaux organolithiques sur l'anneau.
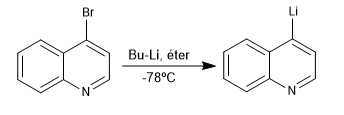
Lire la suite : Réaction de lithiation dans la quinoléine et l'isoquinoléine
- Détails
- Germán Fernández
- THÉORIE QUINOLINE ET ISOQUINOLINE
- Affichages : 1913
Les nucléophiles s'ajoutent au carbone 2 de la quinoléine, bien que dans certaines conditions elle puisse également subir des attaques sur son carbone 4.
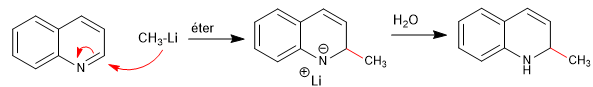
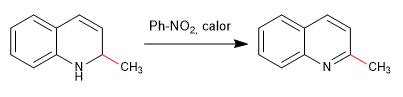
Lire la suite : Addition nucléophile aux quinoléines et isoquinoléines
- Détails
- Germán Fernández
- THÉORIE QUINOLINE ET ISOQUINOLINE
- Affichages : 1933
Les quinoléines halogénées en position 2,4 subissent très facilement des réactions de substitution nucléophile. De son côté, l'isoquinoléine ne peut donner cette réaction qu'en position 1. Tous les nucléophiles ayant la capacité de donner du S N 2 peuvent participer à cette réaction, les mauvais nucléophiles comme l'eau ou les alcools nécessitent un apport de chaleur.
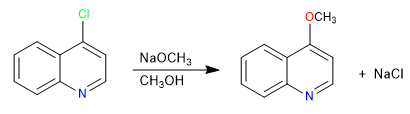
Lire la suite : Substitution nucléophile dans la quinoléine et l'isoquinoléine
- Détails
- Germán Fernández
- THÉORIE QUINOLINE ET ISOQUINOLINE
- Affichages : 1645
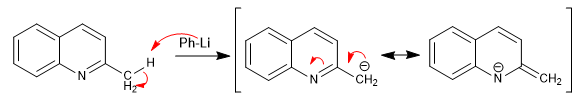
Les pyridines avec des groupes alkyle en position 2,4 ont des hydrogènes acides sur le carbone adjacent au cycle pyridine.
- Détails
- Germán Fernández
- THÉORIE QUINOLINE ET ISOQUINOLINE
- Affichages : 30848
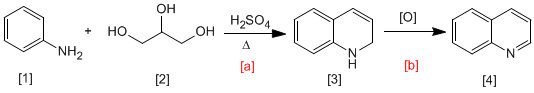
Dans la synthèse de Skraup, l'aniline [1] réagit avec les carbonyles a,b -insaturés en milieu acide pour former des 1,2-dihydroquinoléines [3], qui se transforment en quinoléines par oxydation [4]. Le carbonyle a,b-insaturé peut être obtenu par déshydratation du 1,2,3-propanetrium [2].
- Détails
- Germán Fernández
- THÉORIE QUINOLINE ET ISOQUINOLINE
- Affichages : 8232
Dans la synthèse de Conrad-Limpach, les quinolones sont obtenues en faisant réagir de l'aniline avec des 3-cétoesters. En conditions cinétiques on obtient la 4-quinolone et en conditions thermodynamiques la 2-quinolone.
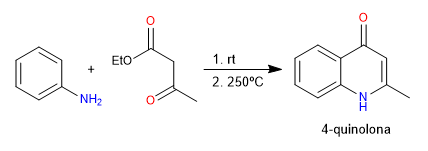
Lire la suite : Synthèse de la quinoléine : Conrad-Limpach-Knorr
- Détails
- Germán Fernández
- THÉORIE QUINOLINE ET ISOQUINOLINE
- Affichages : 2716
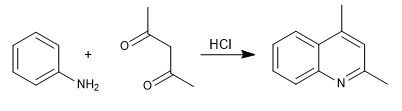
Dans la synthèse de Combes, les quinoléines sont obtenues en faisant réagir l'aniline avec des 1,3-dicarbonyles, en présence d'une catalyse acide. Dans un premier temps, l'imine se forme, qui se tautomérise en énamine,a, activant le cycle aromatique en abandonnant le couple azoté. Dans la dernière étape, la cyclisation se produit par attaque du benzène sur le carbonyle de la chaîne
- Détails
- Germán Fernández
- THÉORIE QUINOLINE ET ISOQUINOLINE
- Affichages : 3065
La synthèse de Friedländer prépare des quinoléines à partir d'un nitrobenzène ortho-acétylé et d'une cétone. La synthèse débute par une condensation aldolique en milieu basique. La réduction du groupe nitro en amino permet la cyclisation par formation d'imine.
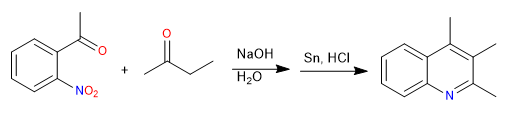
- Détails
- Germán Fernández
- THÉORIE QUINOLINE ET ISOQUINOLINE
- Affichages : 2059
La réaction entre le 2-aminoéthylbenzène et un halogénure d'alcanoyle en présence de pyridine forme un amide. L'amide est converti en électrophile de Vilsmeier par réaction avec l'oxytrichlorure de phosphore. La cyclisation se produit par attaque du benzène audit électrophile. Une oxydation finale génère de l'isoquinoline.
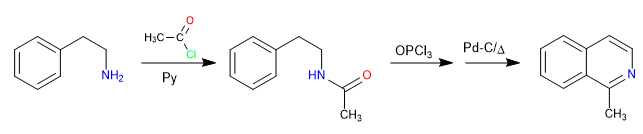
- Détails
- Germán Fernández
- THÉORIE QUINOLINE ET ISOQUINOLINE
- Affichages : 2431
Pictet Spengler est une réaction de type Mannich. Dans la première étape, l'électrophile de Mannich est formé par réaction de l'amine avec un aldéhyde en milieu acide chlorhydrique. Dans l'étape finale, la cyclisation se fait par attaque du benzène sur l'électrophile de Mannich. L'isoquinoléine est obtenue après une double oxydation.
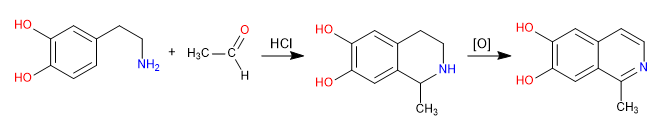
- Détails
- Germán Fernández
- THÉORIE QUINOLINE ET ISOQUINOLINE
- Affichages : 1882
La synthèse Pomeranz-Fritsch prépare des isoquinolines en faisant réagir des benzaldéhydes avec des a-aminoaldéhydes protégés sous forme d'acétals. Dans une première étape, l'imine est formée par réaction entre le benzaldéhyde et l'amine. Dans une deuxième étape, l'acétal est cassé avec de l'acide sulfurique aqueux, laissant l'aldéhyde libre, qui se cyclise sous l'attaque du benzène. 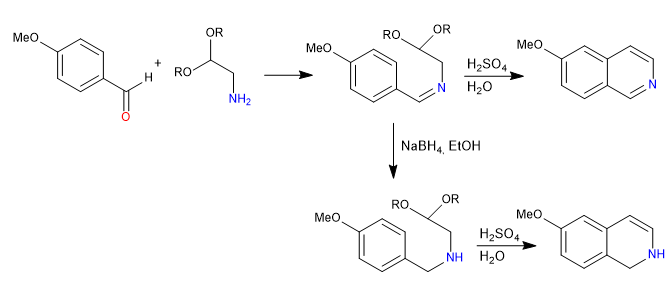
Lire la suite : Synthèse Pomerantz-Fritsch des isoquinoléines